年龄相关的微环境变化突显了PDGF-C在ER+乳腺癌转移复发中的作用
今天给同学们分享一篇实验文章“Age-associated microenvironmental changes highlight the role of PDGF-C in ER+ breast cancer metastatic relapse”,这篇文章发表在Nat Cancer期刊上,影响因子为22.7。

结果解读:
ER乳腺癌转移复发的同种模型
为了研究控制ER乳腺癌复发的机制,作者对四株据报道为ER的小鼠乳腺肿瘤细胞系进行了表征。RNA测序(RNA-seq)证实,与先前报道一致,EMT6细胞表现出克劳丁低、间质样表型,而表达克劳丁的TSAE1、HRM1和F3II细胞显示上皮形态(扩展数据图1a、b)。TSAE1、HRM1和EMT6细胞系的Esr1表达较高,但F3II细胞的表达水平与ER D2A1系及转移性衍生物D2A1-m1和D2A1-m2相当(图1a和扩展数据图1c)。与ER细胞系相比,TSAE1、HRM1和EMT6细胞中ER信号通路基因的上调,而4-羟基酮酸甲氧基苯并三唑(4-OHT)处理降低了ER响应基因Greb1的表达(图1b、c和扩展数据图1d)。同样,TSAE1和HRM1细胞在含雌激素培养基中的增强的集落生长受到4-OHT和选择性ER降解剂富马酸的抑制(图1d和扩展数据图1e)。当在同种免疫能力完整的小鼠中作为原位肿瘤生长时,TSAE1、HRM1和EMT6细胞形成ER + 乳腺肿瘤(图1e)。植入雌二醇颗粒的小鼠促进了TSAE1和在较小程度上HRM1肿瘤的生长(图1f)和扩展数据图(图1f));然而,这三条ER + 细胞系在没有雌激素补充的小鼠中也形成乳腺肿瘤,因此更好地再现了年长女性的较低雌二醇水平。
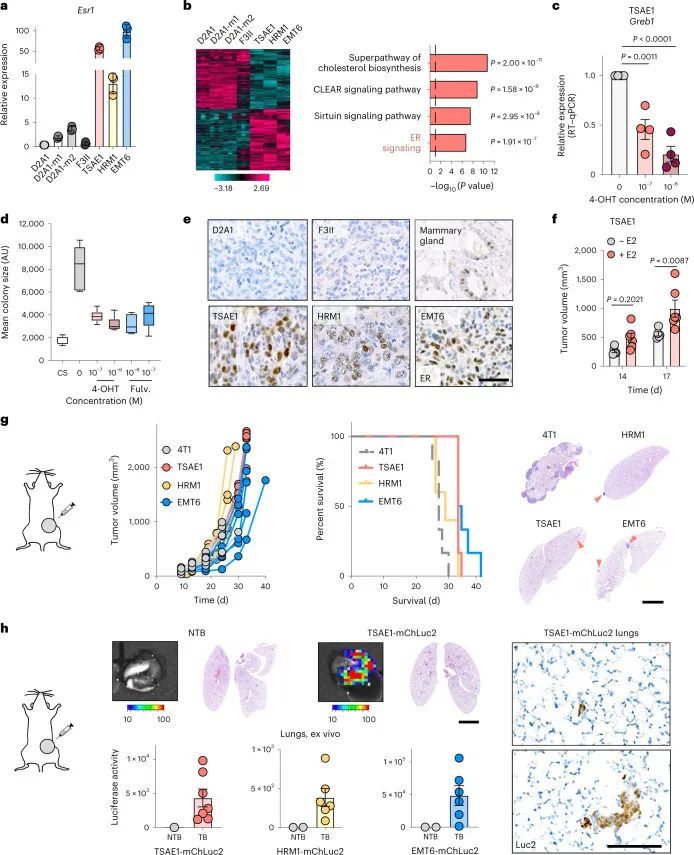
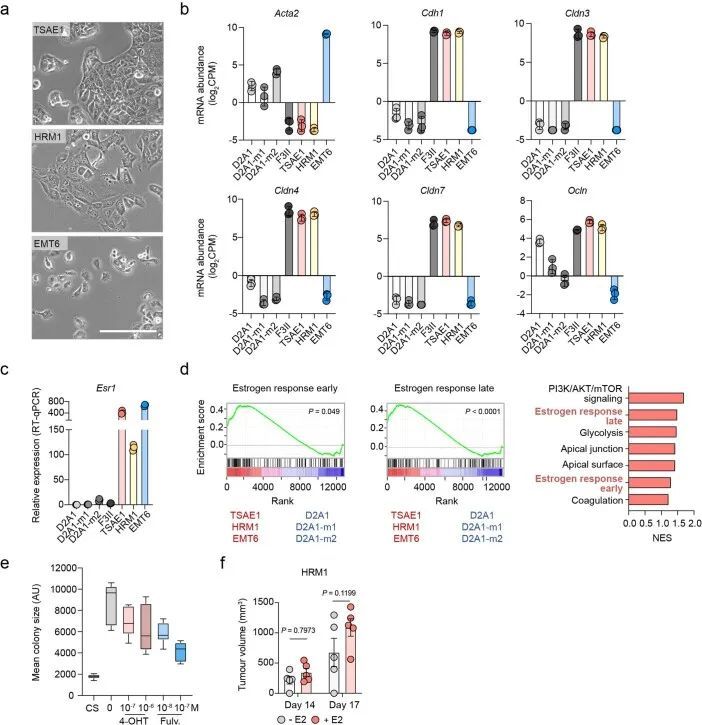
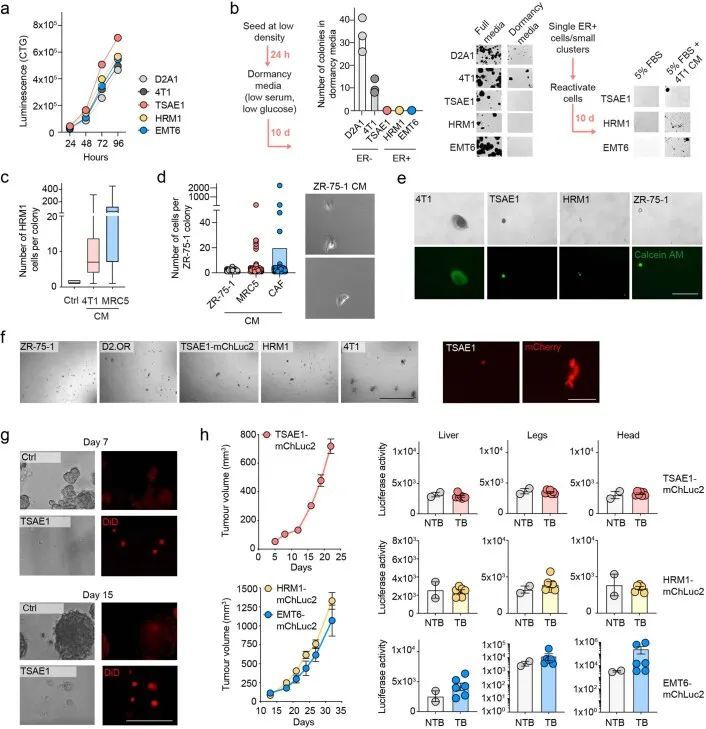
在标准的二维培养条件下,小鼠ER + 细胞系的生长与ER ? 4T1和D2A1细胞系相当(扩展数据图2a),但在低血清培养基中培养7-10天后,显示出非增殖表型,仍保持为单个细胞或小细胞聚集体;然而,这些细胞可以通过后续培养在ER ? 4T1细胞或正常肺成纤维细胞的条件培养基(CM)中重新进入增殖状态(扩展数据图2b、c)。类似的结果也观察到了ZR-75-1人类ER + 乳腺癌细胞,与正常成纤维细胞CM相比,癌相关成纤维细胞(CAF)CM促进了从休眠状态中释放(扩展数据图2d)。同样,ER + 细胞系在软琼脂中培养6周或生长因子减少的基底膜提取物(BME) 4 中培养9-15天时表现出休眠表型,细胞保留了亲脂性染料DiD(扩展数据图2e-g)。当ER + 系列被正位注射到同种小鼠中,没有额外的雌激素,实验因原发肿瘤达到最大允许大小而结束,没有证据表明转移性疾病引起的不良健康状况。事实上,随后的组织病理学研究只发现了一些小鼠肺部的转移性沉积物。相比之下,所有携带4T1肿瘤的小鼠都因转移负担达到终点(图1g)。为了检测肺部的单个DTCs,TSAE1、HRM1和EMT6细胞被改造成表达mCherry和荧光素酶(mChLuc2)。在正位植入后,当肿瘤达到引起症状性转移性疾病的4T1肿瘤大小(约700-1,000 mm 3 )时,使用体内成像系统(IVIS)对器官进行离体成像。检测到阳性的IVIS信号;然而,荧光素酶的免疫染色只显示单个DTCs或小团亚型(通常<10个细胞),肺部没有可检测到的巨转移性疾病(图1h)或其他器官(扩展数据图2h)。鉴于高ER表达和乳腺内皮分类,作者将重点放在TSAE1-BALB/c模型上,并使用HRM1-FVB模型进行验证。由于EMT6细胞系具有非上皮性、克劳丁低表型,作者没有进行进一步的实验。
一个老化的微环境促进了ER DTCs的生长
鉴于远处复发前的较长潜伏期,作者试图确定老化的微环境是否能促进ER DTCs的生长。TSAE1原发肿瘤在老鼠的年龄无论如何都能够正常生长,但是只有单个DTCs或小肿瘤细胞亚型存在于年轻(终点时12周)小鼠的肺部,而老年小鼠(终点时16个月)的肺部显示出明显增加的转移负担(图2a和扩展数据图3a)。使用5-乙炔基-2'-脱氧尿嘧啶(EdU)标记证实,年轻肺部的肿瘤细胞只有一小部分是增殖的,而老年肺部的小亚型和大转移沉积物中发现了数量显著增多的增殖(EdU)肿瘤细胞(图2b和扩展数据图3b)。使用实验性(静脉肿瘤细胞接种)转移模型,所有小鼠的转移负担均大于自发模型中观察到的转移负担,这可能是由于肺部种植的DTC数量较多,尽管年轻小鼠的转移病灶主要限制在肺缘和支气管树,而老年小鼠显示出更高的转移负担和更广泛的转移分布,肺实质中有明显的病灶(图2c和扩展数据图3c)。
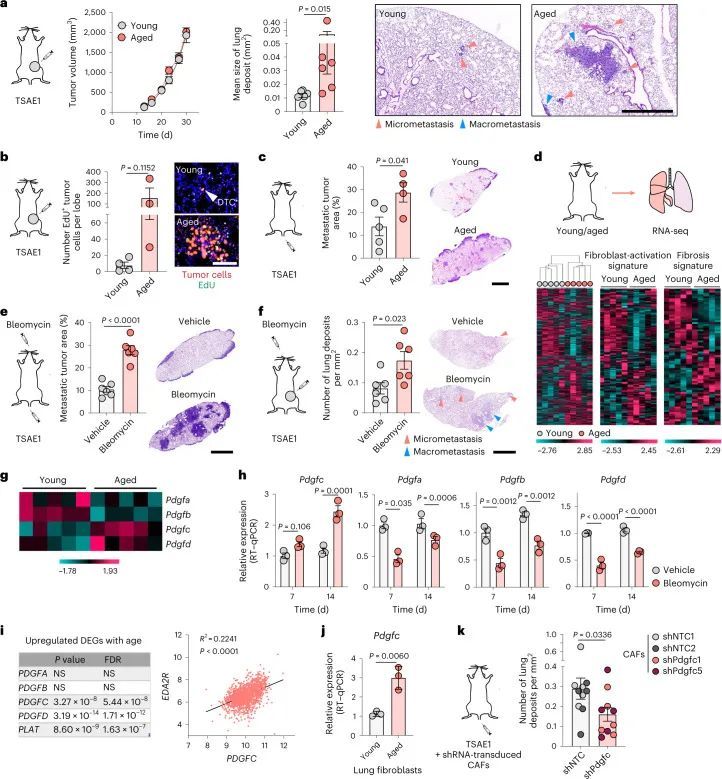
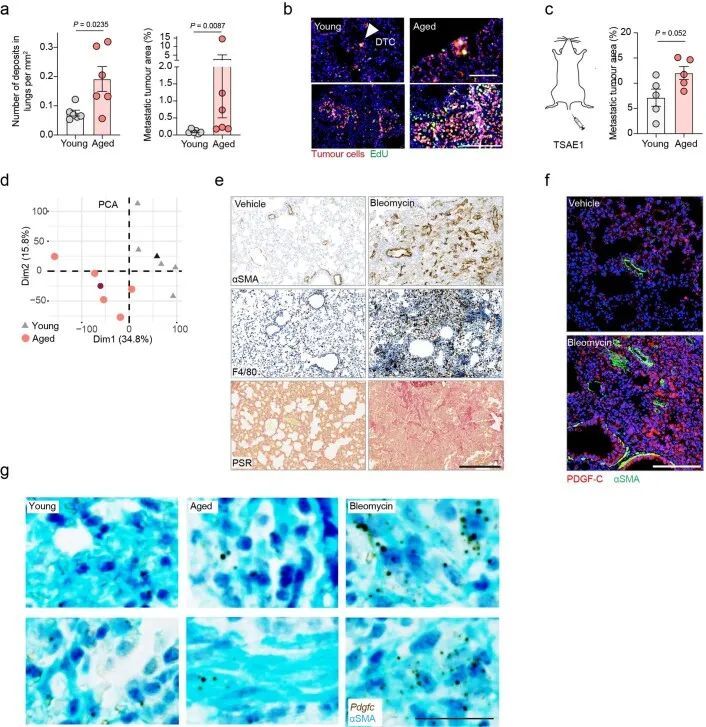
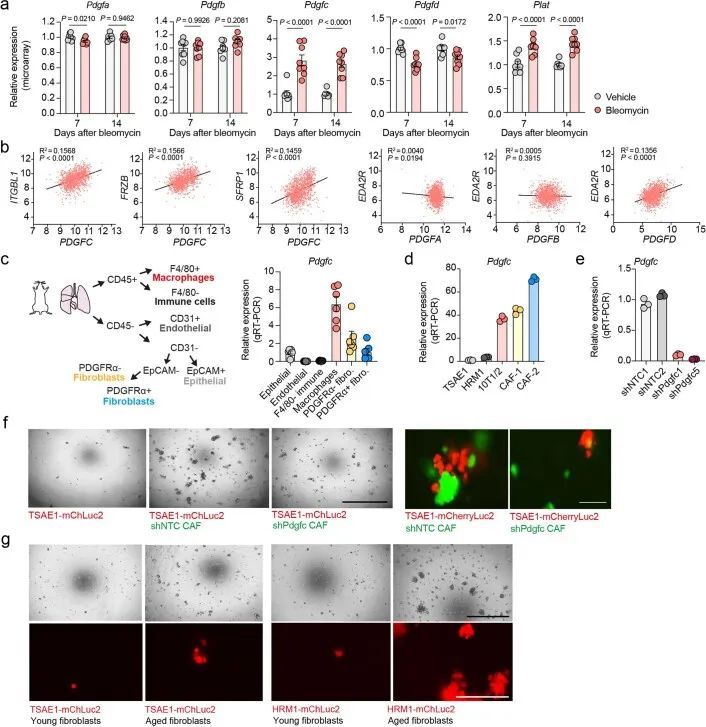
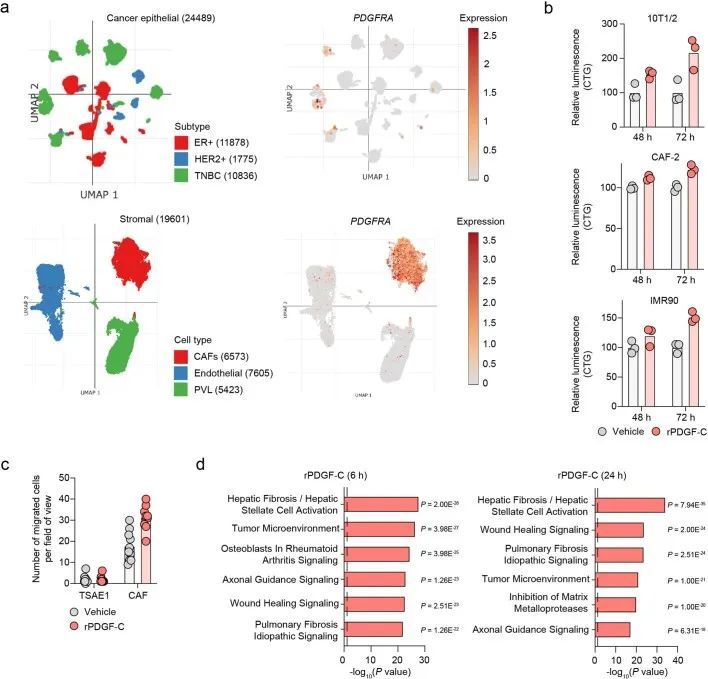
RNA-seq分析显示,BALB/c小鼠的肺部在年轻和老年状态下聚类,与成纤维细胞激活和纤维化基因表达有差异(图2d和扩展数据图3d)。为了模拟肺纤维化,作者使用鼻腔滴注博莱霉素处理,促进成纤维细胞激活、巨噬细胞浸润和胶原沉积增加(扩展数据图3e)。在静脉内或原位接种后,ER + TSAE1细胞在博莱霉素处理的肺部显示出显著增强的转移性生长(图2e,f),肺实质内的巨大转移瘤数量明显增加。鉴于这些发现以及作者体外休眠模型中成纤维细胞细胞因子引起肿瘤细胞增殖的显著再激活(扩展数据图2b-d),作者将重点关注可能在老年小鼠中支持转移性生长的促纤维化因子。有趣的是,作者观察到RNA-seq数据中PDGF家族成员的表达呈现出不同的模式,老年小鼠肺部中经典PDGFs(Pdgfa和Pdgfb)的表达较低,而Pdgfc和Pdgfd的表达却升高(图2g)。此外,在使用博莱霉素处理后的纤维化肺部中,Pdgfc的表达和PDGF-C蛋白水平显著上调,而其他PDGF家族成员的表达显著下调(图2h和扩展数据图3f,g)。这些发现通过对博莱霉素处理的C57BL/6小鼠肺部的独立RNA分析数据集进行验证(扩展数据图4a)。此外,从1,197名年龄在4至85岁之间的患者收集的人肺组织中,PDGFC、PDGFD和PLAT(编码组织纤溶酶原激活物(tPA))的表达与年龄以及EDA2R和其他与年龄相关的基因的表达显著相关,但PDGFA或PDGFB与年龄无相关性(图2i和扩展数据图4b)。
转移到转移微环境中的Pdgfc表达
为了评估转移微环境的变化,作者将非肿瘤携带(NTB)的年轻和老年小鼠(来自图2d)的纤维化相关基因和PDGF家族成员的表达与接种了TSAE1肿瘤细胞的年轻和老年小鼠(肿瘤携带(TB)小鼠)的相应队列进行了比较。与年轻TB小鼠中有限的转移性疾病和老年TB肺部的巨转移病灶一致(图2a和扩展数据图5a),老年TB肺部具有更高的TSAE1肿瘤特征评分,这一模式与成纤维细胞激活和纤维化基因的表达增加相一致,表明在存在转移性疾病的情况下,微环境进一步激活(图3a)。值得注意的是,Pdgfc和Plat的表达在老年小鼠的TB肺部进一步升高,而其他PDGF家族成员的水平进一步降低(图3b)。
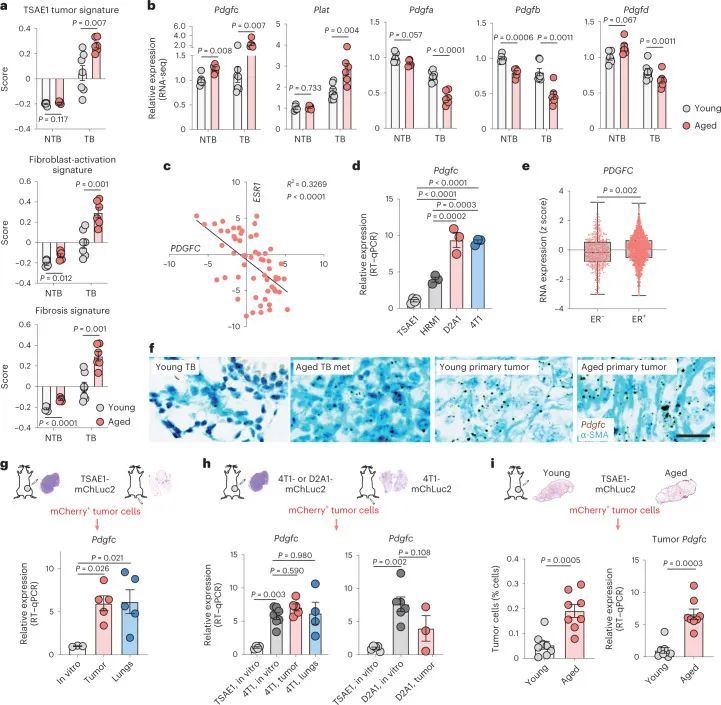
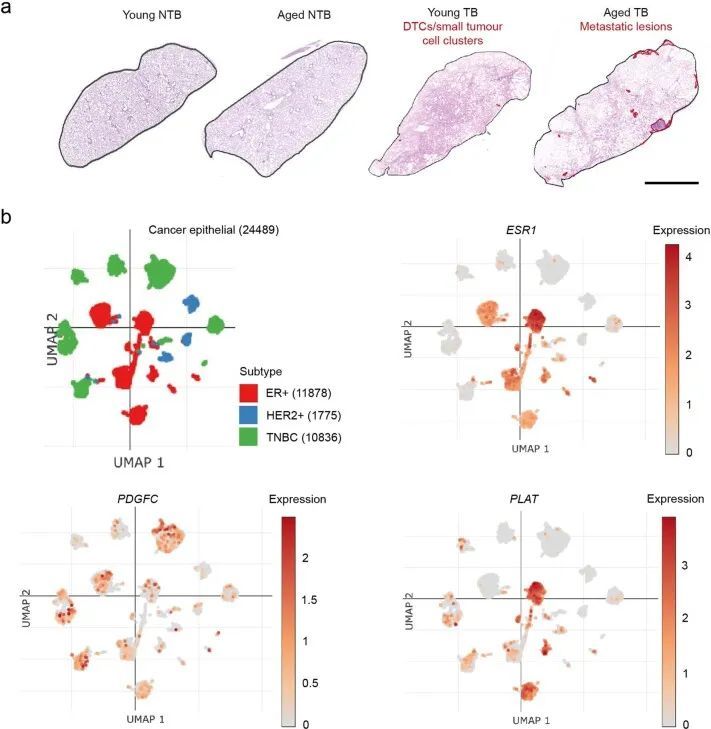
在ER阳性乳腺癌中,肿瘤细胞源性的PDGF-C已被证明能促进CAF的招募。然而,PDGF-C在ER阳性乳腺癌中的作用很大程度上被忽视了,主要是因为体外培养的ER阳性人类乳腺癌细胞系中PDGFC的表达较低。事实上,PDGFC的表达与乳腺癌细胞系中ESR1的表达呈负相关(图3c),并且Pdgfc的表达在培养的ER阳性TSAE1和HRM1肿瘤细胞中显著低于ER阳性D2A1和4T1细胞(图3d)。在人类肿瘤中情况不太清楚,Molecular Taxonomy of Breast Cancer International Consortium(METABRIC)数据集显示ER阳性乳腺癌中PDGFC的表达高于ER阴性乳腺癌(图3e)。由于METABRIC是一种大规模肿瘤分析方法,无法区分肿瘤细胞和基质PDGFC表达;然而,对26例人类乳腺癌进行单细胞RNA测序分析显示,ER和ER肿瘤细胞的PDGFC表达相当,而ER细胞则表达了明显更高水平的PLAT(扩展数据图图5b)。此外,对TSAE1 TB年轻和老年小鼠进行的Pdgfc原位杂交(RNAscope)显示,老年小鼠肺部的原发肿瘤和转移病灶中Pdgfc得到了广泛上调(图3f),这一结果共同表明肿瘤细胞可能对老年TB小鼠肺部中Pdgfc的表达增加起到了贡献。
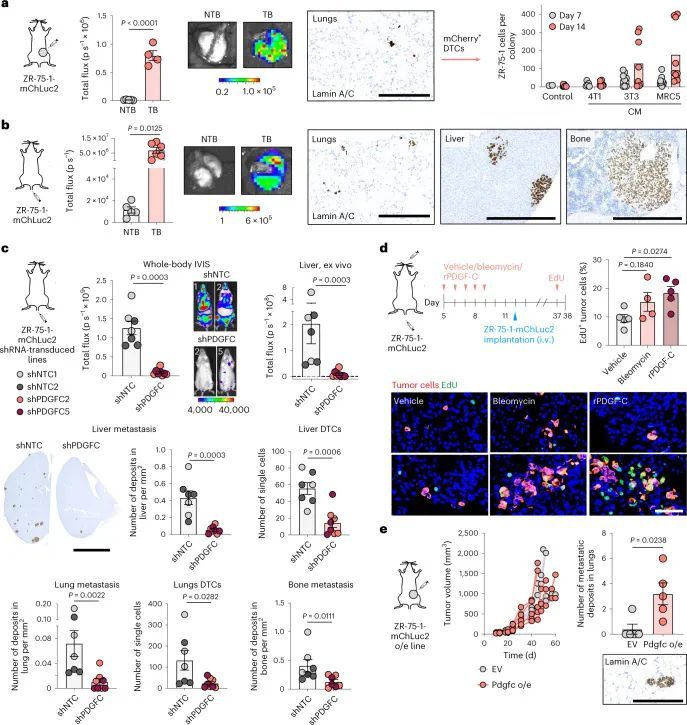
为了解决这个问题,作者从原发肿瘤和肺部转移病灶中分离出TSAE1-mChLuc2肿瘤细胞。与培养中的细胞相比,ER + 肿瘤细胞在体内明显上调了Pdgfc的表达,而Pdgfa和Pdgfb没有(图3g和扩展数据图6a)。同样,使用人源特异性PDGFC探针评估的肿瘤细胞PDGFC,在ER + ZR-75-1肿瘤中上调,与培养中的ZR-75-1细胞相比(扩展数据图6b)。相比之下,PDGF-C hi ER ? D2A1和4T1细胞在体内没有进一步上调Pdgfc的表达(图3h)。令人惊讶的是,从年轻和老年肺部分离的TSAE1细胞显示出老年TB肺中肿瘤细胞数量和Pdgfc表达明显上调的情况(图3i),这表明与休眠DTCs相比,Pdgfc表达在转移病灶中的ER + 肿瘤细胞中上调。至少在某种程度上,这可能反映了与大肿瘤转移病灶相关的活化微环境,因为ER + 肿瘤细胞的Pdgfc或PDGFC表达可能是通过与PDGF-C hi CAFs共培养诱导的(扩展数据图6c)。相反,PDGF-C hi ER ? 4T1和AT-3细胞在老龄BALB/c和C57BL/6小鼠中未显示出增加的转移定植能力,这表明它们高内源性的Pdgfc表达足以在年轻肺部的PDGF-C lo 微环境中启动转移定植(扩展数据图6d-f)。
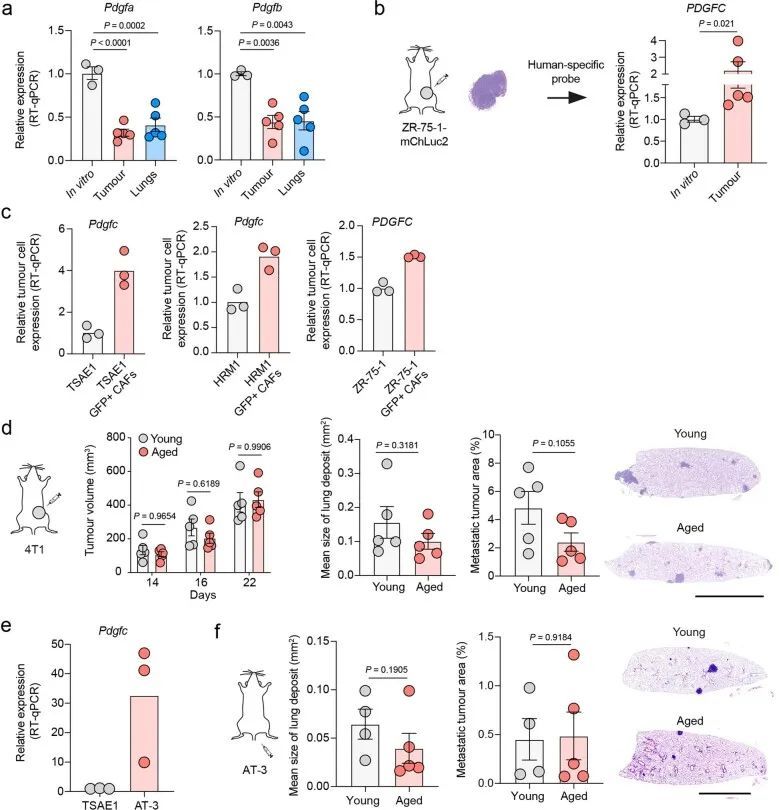
肿瘤细胞PDGF-C支持DTC的存活和生长
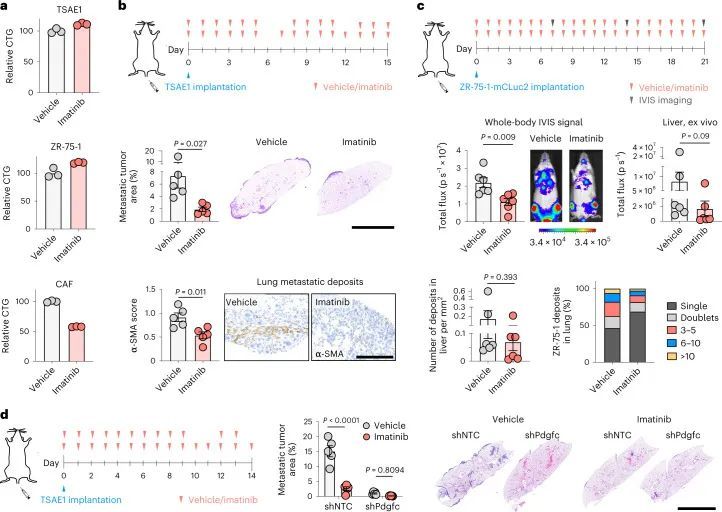
为了测试肿瘤细胞源性PDGF-C在生长的转移病灶中是否有助于产生有益的转移环境,TSAE1细胞被转导为shNTC1或shNTC2,或者两种独立靶向Pdgfc的shRNA物种(shPdgfc1,shPdgfc5)。所有shRNA株系在体外显示出相似的生长速率(图4a,b)。正如先前所示,静脉接种后,ER + TSAE1细胞在肺部扩散的数量增加,部分克服了PDGF-C lo 微环境的不足(图2c,e),在这些实验中,Pdgfc的沉默显著限制了转移性生长(图4c),这一发现在HRM1 ER + 模型中得到了重复(图4d和扩展数据图7a,b)。重要的是,在博莱霉素诱导的肺纤维化模型中,基质PDGF-C水平升高,肺部微环境被广泛激活(图2h和扩展数据图3e-g),TSAE1-shPdgfc和TSAE1-shNTC细胞显示出相似的转移性生长(图4e)。当正位接种时,TSAE1-shNTC和TSAE1-shPdgfc原发肿瘤在年轻小鼠中生长相当(图4f),免疫组化分析证实Pdgfc的沉默在体内得到了维持(扩展数据图7c)。与先前观察到的一样(图1g、h和2b),带有TSAE1-shNTC肿瘤的年轻小鼠显示出少量巨大转移病灶的休眠播散疾病的证据。Pdgfc的耗竭进一步减少了这种转移殖民(图4f),表明低水平肿瘤源性PDGF-C在ER + DTC存活中起到了作用。最后,为了支持休眠DTC生长所需的PDGF-C hi 微环境,Pdgfc的过表达(图4g),在体外细胞增殖或原发肿瘤生长方面没有影响,但显著增加了转移负担(图4h)。
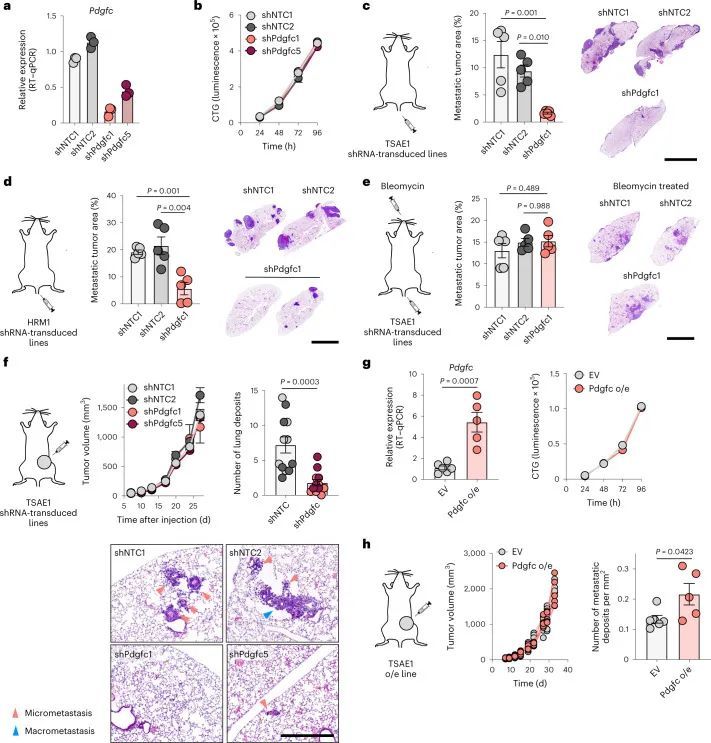
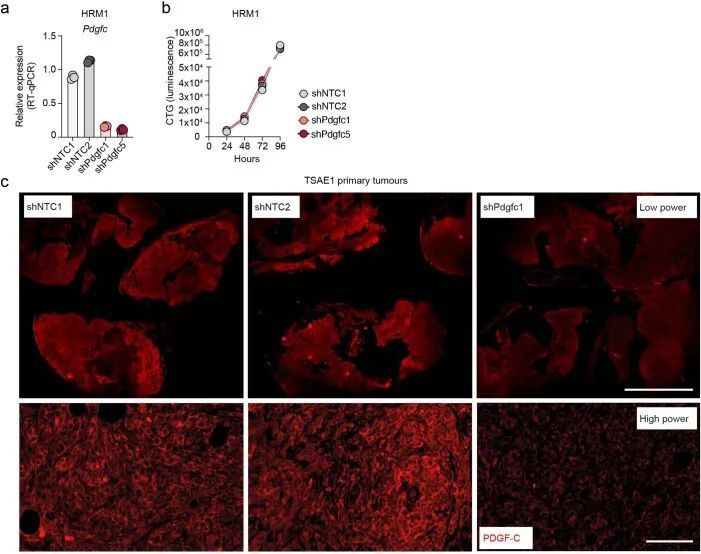
PDGF-C介导的成纤维细胞激活
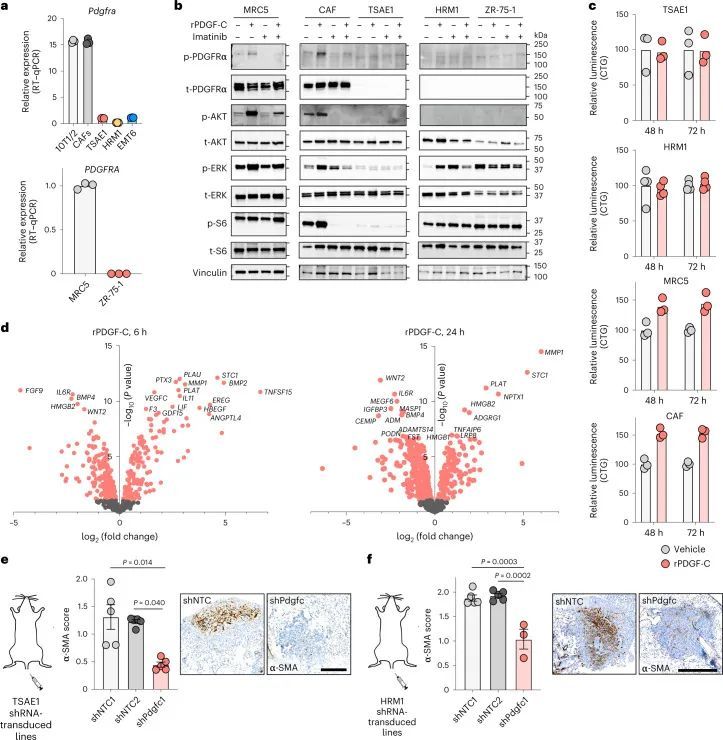
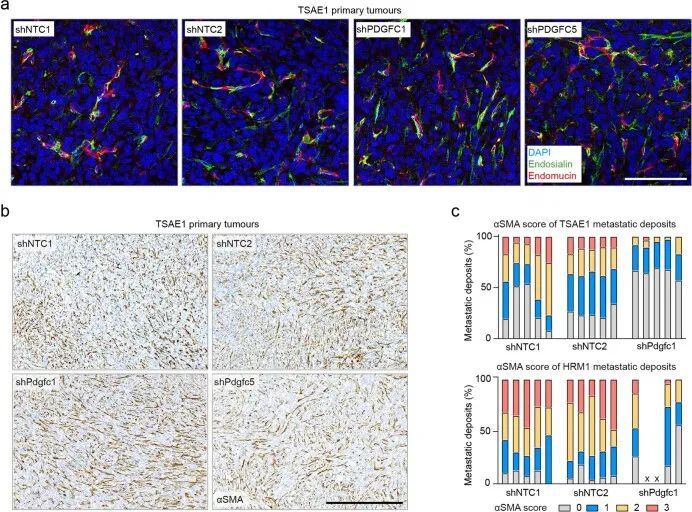
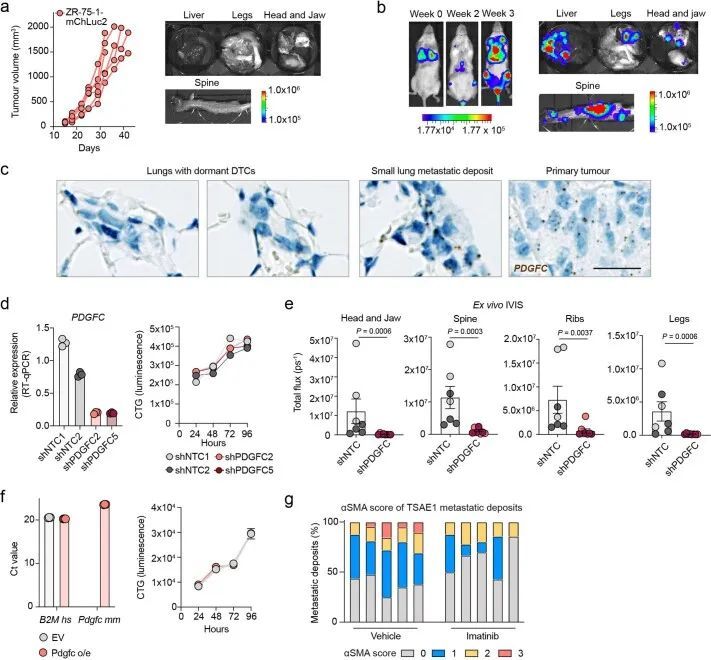
PDGFRA编码的PDGF-C受体在正常肺组织(人类蛋白质图谱,http://www.proteinatlas.org)和原发性人类乳腺癌中仅限于成纤维细胞(Extended Data Fig. Fig.8a)。同样,在此处使用的ER肿瘤细胞中,与小鼠(CAF,10T1/2)或人类(MRC5)成纤维细胞相比,Pdgfra和PDGFRA mRNA以及PDGFRα蛋白水平微不足道(Fig. 5a,b)。事实上,重组PDGF-C(rPDGF-C)处理成纤维细胞而不是ER肿瘤细胞促进了PDGFRα、AKT、ERK和S6的磷酸化,而这些磷酸化可以被PDGFRα抑制剂伊马替尼所抑制(Fig. (Fig.5b),并且与先前的报告一致,成纤维细胞增殖和迁移在rPDGF-C处理后增加。rPDGF-C处理的MRC5成纤维细胞的RNA-seq分析和分泌转录组的分析表明,纤维化和伤口愈合途径的富集以及PLAT表达增加。PDGF-C据报道可促使血管周围的CAF(成纤维细胞)积聚,但作者观察到在经过shNTC或shPdgfc转导的TSAE1原发肿瘤中,血管密度、血管周围的血管平滑肌细胞或CAF覆盖率没有差异(扩展数据图9a),激活的(α平滑肌肌动蛋白(α-SMA))成纤维细胞数量也没有差异(扩展数据图9b)。然而,在经过静脉接种TSAE1或HRM1细胞后,shPdgfc转移病灶中的α-SMA成纤维细胞明显减少(图5e、f和扩展数据图9c),这表明在年轻的肺微环境中,肿瘤源性PDGF-C对于促进成纤维细胞的招募和激活是必需的。
PDGF-C在人类ER模型的转移复发中的作用
为了将这些研究扩展到人类乳腺癌,作者使用了人类ER + 乳腺癌细胞系ZR-75-1。尽管将ZR-75-1细胞正位接种到缺乏功能性免疫系统的NOD SCID gamma (NSG)小鼠体内,但在肺部只发现单个DTCs或小细胞亚型,很少有扩散到其他器官的证据(图6a和扩展数据图10a)。在肺部解离后,分离的ZR-75-1细胞在体外仍保持非增殖状态,但可以通过成纤维细胞CM重新激活(图(图6a)),这与体外休眠实验的结果一致(扩展数据图2b-d)。当静脉注射ZR-75-1细胞时,细胞扩散到肺部并且基本上保持休眠状态;然而,扩散到肝脏和骨骼的肿瘤细胞,这是乳腺癌常见的转移部位,最终形成巨大的转移瘤(图6b和扩展数据图10b)。使用人类特异性探针(扩展数据图10c)的PDGFC RNAscope证实了分离的肿瘤细胞的逆转录定量PCR(RT-qPCR)分析的结果(扩展数据图图6b),6b),显示ZR-75-1原发肿瘤细胞中PDGFC表达上调,但DTCs中PDGFC表达水平较低,再次支持休眠DTCs是PDGF-C lo 。生成两个独立的ZR-75-1-shPDGFC细胞系证实,在体外下调PDGFC不影响肿瘤细胞增殖(扩展数据图10d),但在静脉接种后,显著减少单个DTCs和较大病灶的数量(图6c和扩展数据图10e)。相反,用rPDGF-C或博莱霉素预处理年轻小鼠的肺促进DTC增殖(图 (图6d)。综上所述,这些发现表明肿瘤细胞源PDGF-C在支持DTC(PDGF-C lo )存活和转移性(PDGF-C hi )生长中起到关键作用。PDGF-C的这种作用在ZR-75-1细胞异位表达Pdgfc的自发转移模型中得到进一步证实,该模型中细胞不仅保持为单个休眠细胞 (图6a),而且形成转移性沉积物(图6e和扩展数据图10f)。
PDGF-C信号传导阻断损害ER+转移生长
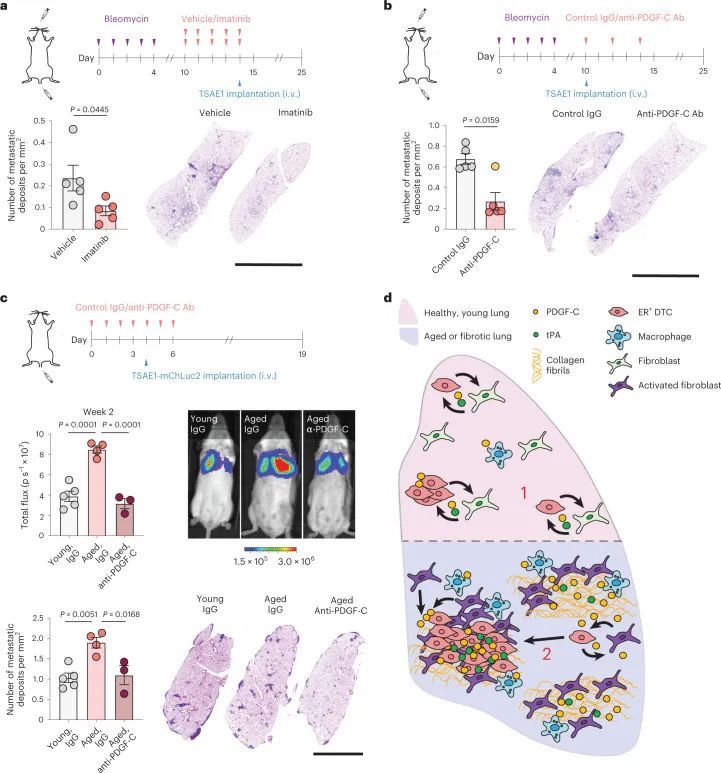
鉴于肿瘤衍生的Pdgfc在ER+DTC生存和生长中的作用,作者评估了使用伊马替尼对PDGFRα的药理学抑制是否限制了转移生长。正如预期的那样,考虑到成纤维细胞限制Pdgfra和Pdgfra的表达,伊马替尼影响CAF,但不影响肿瘤细胞的生存能力(图7a)静脉接种TSAE1细胞的小鼠的伊马替尼治疗抑制了肺中的转移性生长,并减少了转移性病变中成纤维细胞的活化(图7b和扩展数据图10g)。类似地,伊马替尼治疗显著降低了ZR-75-1的全身转移,其趋势是肝脏中转移生长较少,肺部中DTC发展为肿瘤细胞亚型的比例较小(图7c)。如前所示(图4c),TSAE1细胞中Pdgfc的缺失严重损害了转移生长(图7d),,当与伊马替尼联合治疗时,肺肿瘤细胞含量略有但不显著的额外减少,这可能至少部分是由于伊马替尼可抑制成纤维细胞上的PDGFRα,而成纤维细胞对肿瘤细胞和非肿瘤细胞衍生的PDGF-C都有反应。最后,作者试图确定在PDGF-Chi纤维化和老年肺中靶向PDGF-C信号是否可以抑制ER+DTC的转移生长。在TSAE1细胞接种前用伊马替尼治疗纤维化肺,或从TSAE1接种之日起用PDGF-C阻断抗体治疗纤维化肺25,26,在减少转移生长方面同样有效(图8a,b)。类似地,PDGF-C阻断抗体显著减少了在衰老小鼠中观察到的转移生长增加(图8c)。
总结
在这项研究中,作者对同基因模型的ER乳腺癌进行了表征和利用,以展示由于衰老或纤维化损伤引起的微环境变化如何支持DTC的增殖和生长。通过转录组分析,作者确定了Pdgfc作为在衰老和纤维化肺部上调的关键因子,与激活的成纤维细胞积累和增强的转移生长有关。相比之下,在年轻小鼠的PDGF-C微环境中,通过散布的ER肿瘤细胞表达Pdgfc对DTC的存活是必需的,突显了靶向PDGF-C信号传导以限制ER乳腺癌复发的机会。
本文来自互联网用户投稿,该文观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。 如若内容造成侵权/违法违规/事实不符,请联系我的编程经验分享网邮箱:chenni525@qq.com进行投诉反馈,一经查实,立即删除!
- Python教程
- 深入理解 MySQL 中的 HAVING 关键字和聚合函数
- Qt之QChar编码(1)
- MyBatis入门基础篇
- 用Python脚本实现FFmpeg批量转换
- 光伏系统的优势有哪些
- 插入排序 InsertionSort
- Android app无障碍服务增加
- 计算机毕业设计------SSM的公寓房屋出租系统
- ?iOS实时查看App运行日志
- 算法导论复习五 递归树求解递归表达式题目练习
- 黑马程序员JavaWeb开发|原理篇
- vue3 实现el-date-picker日期筛选过程
- 平头哥玄铁系列 RISC-V 芯片及开发板
- 一文读懂OTA【赠书活动|第12期《一书读懂物联网:基础知识+运行机制+工程实现》】