单细胞转录组学对代谢功能障碍相关脂肪变性肝病的类器官模型进行分析

前言
最近接触比较多肝纤维化项目,包括空转、单细胞和普通的BULK转录组,本文是肝脏疾病类器官构建,所以结果是比较确定的,只是对比不同处理和培养哪种效果更好,适合了解纤维化进展和哪些分子和细胞参与,以及其机制;此外本文数据使用Python分析数据的图很好看,之后可以复现一下。

摘要
代谢功能障碍相关脂肪变性肝病(MASLD)发病率不断上升,而且有效治疗方式很少。因此,测试新疗法的体外系统是必不可少的。虽然最近出现了人类肝脏类器官模型来评估脂肪变性肝病,但对其转化潜力的系统评估仍然缺失。在这里,我们评估了MASLD的人类肝脏类器官模型,比较测试了三种条件下的疾病诱导:油酸(OA)、棕榈酸(PA)和TGF-β1。通过单细胞分析,我们发现所有三种模型都能诱导炎症信号,但只有TGF-β1能促进胶原生成、纤维化和肝星状细胞扩张。与此形成鲜明对比的是,油酸可以改善纤维化特征,减少肝星状细胞数量。将每个模型的数据与MASLD疾病进展相关的基因表达特征联系起来,进一步证明棕榈酸和TGF-β1更有力地模拟炎症和纤维化。我们的研究结果说明了通过临床疾病进展特征对MASLD类器官模型进行分层的重要性,为未来的类器官损伤模型提供了单细胞参考,并使我们能够在动态、多谱系的人类体外系统中研究不断演变的脂肪性肝炎、纤维化和HSC对损伤的易感性。
肝病进展过程
从脂肪肝(steatosis)→ 肝脏炎症(MASH)→ 肝纤维化(fibrosis) → 肝硬化(cirrhosis) 是一个逐渐发展的过程。为了区分肝纤维化的严重程度,医生们把肝纤维化分为F0、F1、F2、F3和F4,5个等级:F0为无肝纤维化,≥F1为轻度肝纤维化,≥F2为中度肝纤维化,≥F3为重度肝纤维化,F4为肝硬化。
肝硬化是肝纤维化发展到最严重的结果;
肝纤维化是可逆的过程;
只有30%的steatosis会进展到MASH
非酒精性脂肪肝模型
代谢功能障碍相关脂肪变性肝病(MASLD)又叫非酒精性脂肪肝,与肝脏脂肪代谢异常有关。
脂肪酸可以激活肝细胞炎症通路,使其分泌细胞因子比如肿瘤酸死因子(TNF)从而激活Kuffer细胞,Kuffer细胞和招募的其他免疫细胞释放TGF-β,TGF-β可以激活HSC细胞(肝星状细胞)转分化为肌成纤维细胞。
肌成纤维细胞释放细胞外基质(主要是collagen type I 和 III)形成纤维瘢痕。
MASLD的关键是肝脏中脂肪酸的长期暴漏,因此可以人多能干细胞产生肝脏类器官,再给予OA、PA、TGF-β1刺激构建疾病模型。有两种细胞培养方式ULA(超薄附着物板)和OS(摇床)
结果1:类器官模型包括了肝脏中多种细胞类型
首先验证模型有效性,图A使整体实验设计图,从hPSCs人多潜能干细胞分化成HLOs肝脏类器官,四种不同培养环境产生肝类器模型,选出最优培养方式OS,再用不同刺激构建疾病模型,再评估炎症和纤维化程度,脂肪肝模型有效性评分。图B用RT-pRCR说明多潜能基因表达下降,肝脏基因表达上升,图C从组织学水平说明模型有效性。
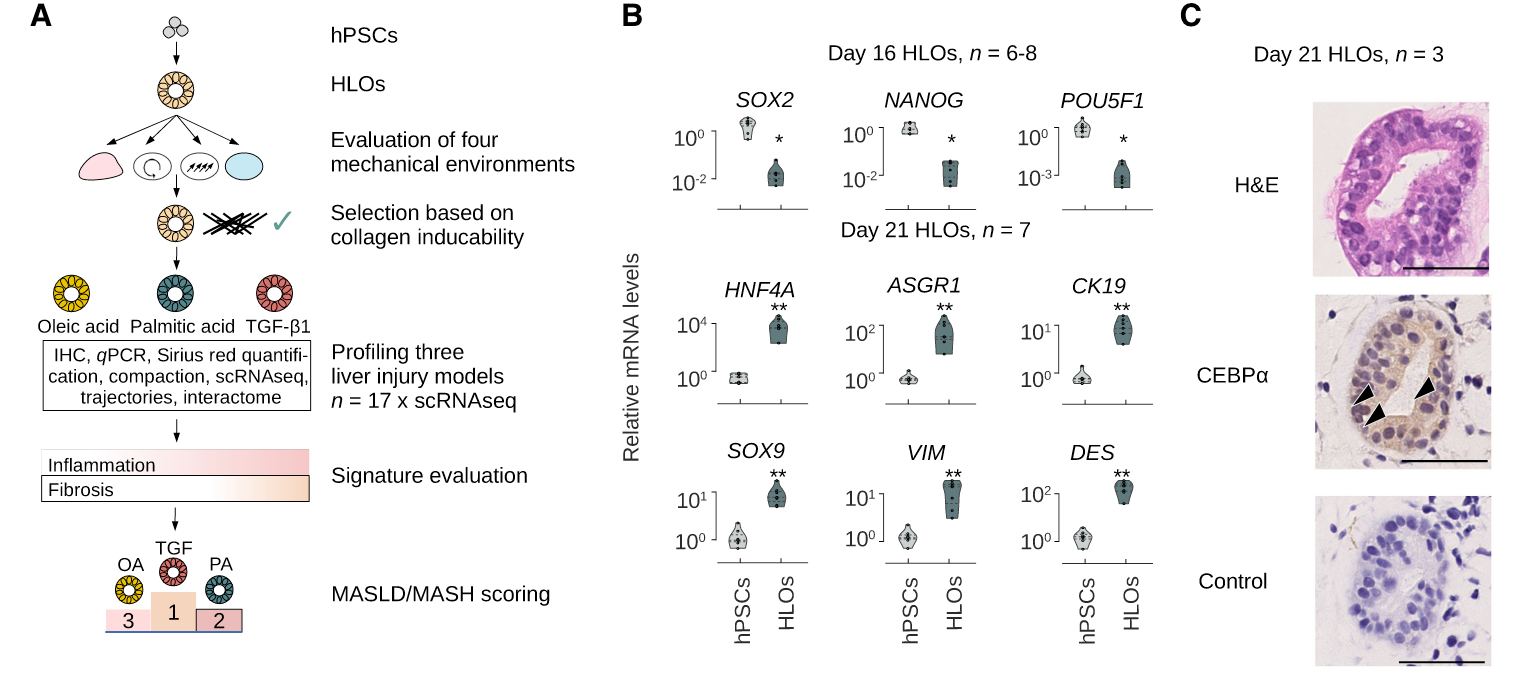
接下来是单细胞测序数据,作者使用了3种注释方法,注释到了4种肝脏中的主要细胞hepatocyte(肝细胞)、HSC(肝星状细胞)、 cholangiocyte(胆管上皮细胞)、ESC(胚胎干细胞);图E为细胞marker基因表达情况;图F是对应的细胞类型的差异基因富集到的通路
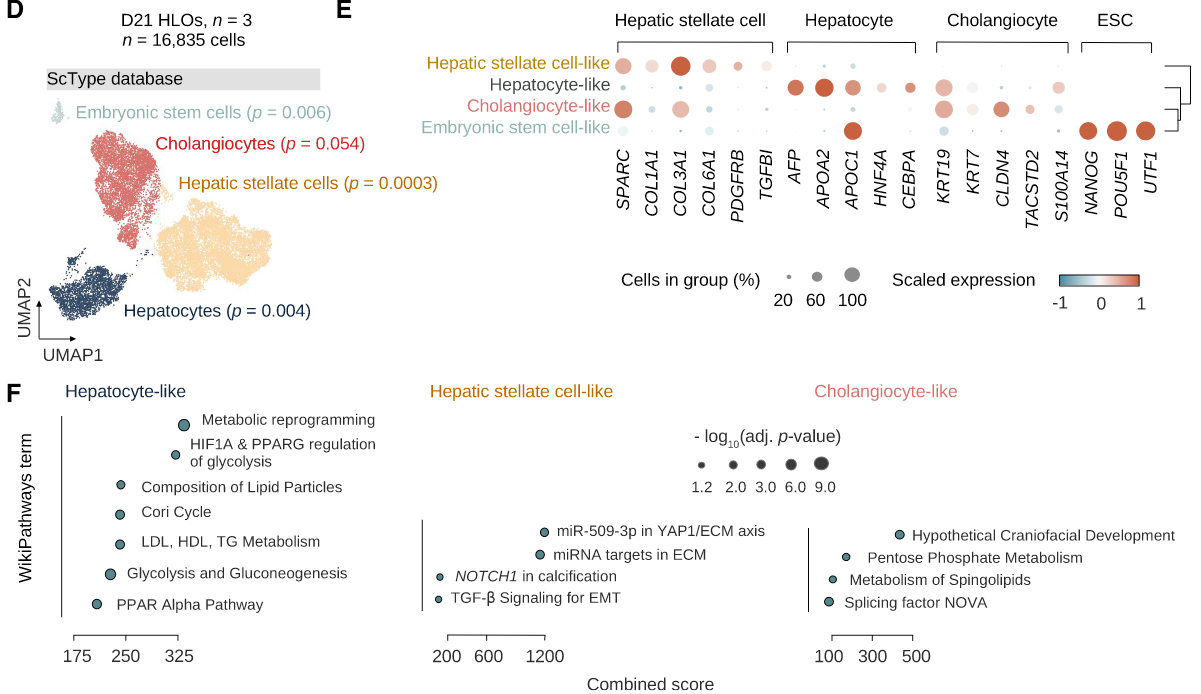
结果2:不同培养方式影响肝细胞成熟、细胞类型分布
图A有两种细胞培养方式ULA(超薄附着物板)和OS(摇床);
图B和之后的许多单细胞展示图都是用了ForceAtlas2图,可以展示空间过程(spatialization process),图B-C说明两种培养条件细胞类型分布和比例不同。
图D说明ULA培养方式HSC细胞marker基因表达更高;
图E 肝细胞差异基因除了富集到代谢通路,还富集到了strogen metabolism 、 coagulationrelated pathways等通路
图F:细分肝细胞亚群为hepatoblast-, fetal hepatocyte-, and adult hepatocyte-like cell等,FA图看下细胞类型分布
图G:查看marker基因表达情况,说明两种培养方式产生的肝细胞亚群种类有差异
图H:空间区域打分,根据PMID: 36109670文章中定义的6群细胞marker基因,给自己的数据打分(相当于注释了细胞类型为0-5类),并观察到肝细胞主要分布在 periportal, interzonal, and pericentral zones(Periportal-C5:0, Periportal-C14:1, Periportal-C6:2, Interzonal-C15:3, Pericentral-C1:4, Pericentral-C3:5,0-5不同数字表示不同区域)
综上,比较了不同培养方式影响肝细胞成熟、细胞类型分布,得出结论OS培养方式出来的细胞更成熟


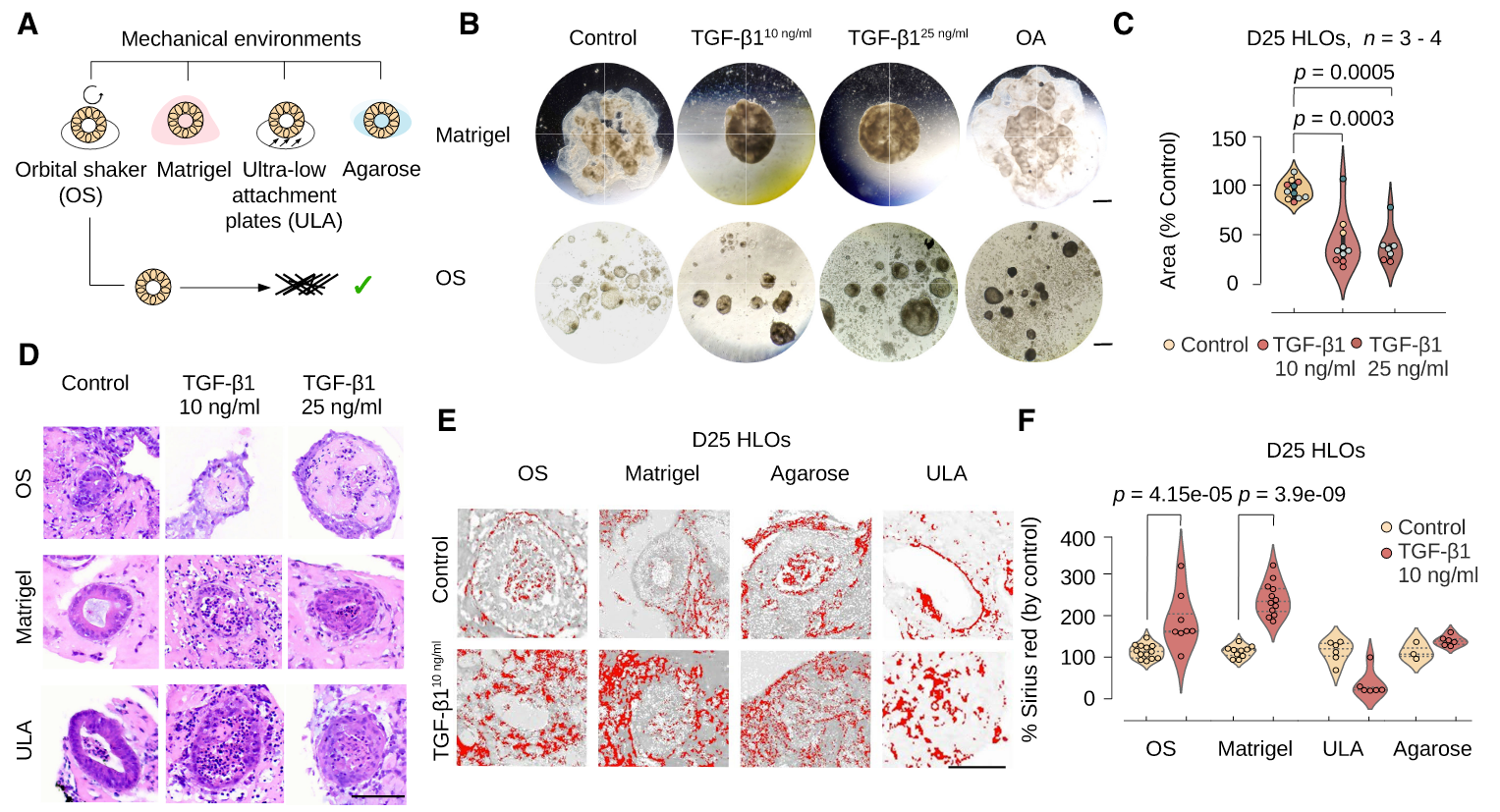
结果3:纤维化类器官模型
前边的都是正常模型,非疾病模型,这里使用TGF-β1刺激产生纤维化类器官模型
图A四种培养方式
图B两种培养方式3种刺激,TGF-β1刺激使细胞形态变化,表面变粗糙,OA作为对比再OS培养条件下也变黑了,这说明TGF-β1刺激可以模拟肝纤维化。
图C-D:TGF-β1刺激使细胞细胞变小
图E-F:天狼猩红染色看type I and III collagen纤维化细胞中沉积,只有OS和Matrigel培养方式有显著性差异,说明这两种培养方式可以模拟纤维化
图G:RT-qPCR结果说明只有TGF-β1+OS培养条件下collagen基因表达有差异
图H:BODIPY染色,看TGF-β1、OA、PA暴漏下脂肪积累都增加;
图I:BODIPY染色,画一个区域统计里边没有染色到的地方,只有OA条件下有差异;
图J:甘油三酯差异
图K:天狼猩红染色看type I and III collagen沉积,只有OA暴露可以减少collagen累积(蛋白水平);
图L:与K一致的结论,collagen的基因COL1A1在OA暴露条件下表达下降(转录水平);PA 暴露条件下TNFA表达上升(促进炎症)
综上:TGF-β1在OS培养条件下可以模拟纤维化,OA、PA刺激下有不同的表型与TGF-β1对比


结果4:单细胞水平下3种刺激有不同的炎症反应和纤维化状态
图A:OS培养环境OA、PA、TGF-β1暴露下,单细胞测序,颜色为暴露条件
图B:FA图细胞类型注释,颜色为细胞类型,细胞比例变化;OA 暴露 可以减少 HSC-like cells 比例并增加 hepatocyte-like cells比例
图C:细胞marker基因表达
图D:OA、PA、TGF-β1、Control条件下细胞周期,通路评分情况
图E:OA、PA、TGF-β1条件下纤维化和炎症基因在各细胞类型中的表达差异
图F:差异基因富集(图比较好看,之后可以模仿画一下)
综上:不同处理下细胞比例差异;炎症基因,纤维化基因表达差异;富集通路差异


结果5:OA处理下的细胞通讯与PA和TGF-β1不同
使用CellPhoneDB分析细胞通讯情况
图A:色块颜色表示该通讯占总的通讯数量的百分比。总体上三种处理后细胞通讯数量增加;OA处理主要增加hepatoblast 2-, cholangiocyte-, and DC-like cells (HB2, CHOLs, DCs)细胞间的通讯;PA处理主要增加cholangiocyte-like, hepatocyte progenitor-, fibroblast- and SMC-like cells (CHOLs, DCs, HB1, FIBs, SMCs)细胞间的通讯;TGF-β1处理主要增加SMC- (most likely representing myofibroblast-like cells) and HSCs-like cells,HSCs-SMC-like cell 、 HSCAH-like 细胞间的通讯
图B:细胞通讯数量比例图,OA处理减少SMC-like参与的通讯;TGF-β1处理增加SMC-like参与的通讯;
图C:处理相对于对照的通讯比例变化量(delta)聚类热图,说明TGF-β1诱导的通讯模式与OA和PA不同;整体上三种处理后与肝纤维化相关的细胞类型HSCs、SMCs通讯都有变化;
图D:详细分析疾病模型中细胞特异的通讯类型了;PA处理后出现TNF superfamily (TNFS) 通讯,说明了炎症反应;TGF-β1处理后出现 PDGFB 和 PDGFRB通讯,说明了肝纤维化;OA处理后出现CXL2 和 DPP4通讯,而DPP4与脂肪变性有关;
图E:三种处理、control之间显著的受配体交集;
图F:OA处理后新的通讯方式DPP4-CXCL12,说明HSC与肝细胞和成纤维细胞之间通过CXCL12通讯;
PA处理后出现HB-like cells (TNFS10) → SMC-like cells (TNFRSF11B)通讯,TNFS10编码TNF-Related Apoptosis Inducing Ligand (TRAIL)自噬配体,TNFRSF11B编码TRAIL的受体 Osteoprotegerin (OPG) ;TGF-β1处理后出现matured hepatocyte cells (TNFRSF11B) → SMC-like cells (TNFS10)通讯;OPG表达说明在肝纤维化中TRAIL诱导的自噬需要肌成纤维细胞激活,与SMC-like cells间的通讯增强说明PA 和 TGF-β1处理后肌成纤维细胞逐渐纤维原激活;
PA 和 TGF-β1处理后的SMC-like cells (SPP1&CD44)(自分泌)通讯,SPP1编码Osteopontin可以结合CD44,进而调节细胞粘附和迁移
TGF-β1处理后的肝细胞(PDGFRA) → HSC通讯,肝细胞(PDGFRB) → HSC通讯,肝细胞(PDGFRB) → SMC通讯,DC管细胞(PDGFRB) → HSC通讯,DC管细胞(PDGFRB) → SMC通讯,PDGFB在肝纤维化中参与介导HSC激活;
综上:描述了3种处理后细胞通讯变化,并且发现了新的少研究的TGF-β1处理后的SMC(TGFB1/CD44)→ 肝细胞(Androgen receptor (AR)/FGFR2)通讯,并且作者认为AR可以作为潜在的靶点


结果6:细胞轨迹分析
从脂肪变性到脂肪性肝炎,再到纤维化,可以理解为一个连续的过程,包括肌成纤维细胞谱系的出现。基于fa图,使用Palantir做轨迹分析
图A:A-C首先分析肝细胞分化,细胞类型fa图
图B:(上)箭头指向分化末端的细胞类型,分化起点是根据肝细胞前体的marker基因CEBPA和AFP表达情况,hepatoblast-like细胞发育成cAH:cycling adult hepatocyte-like state;cholangiocyte细胞发育成DC-like terminal states细胞;(下)分化潜能
图C:根据3个branch分化概率选择top100 细胞,然后查看3种分支细胞的分布和在不同处理中的比例;cAH主要分布在control组,DC主要分布在TGF-β1组;
图D–F :对HSC亚群进行类似A-C的分析,选择IGFBP highest/DDIT4 pos为起始细胞,有5个分化末端HSC1-3、fibroblast-like cluster (FIB)、SMC;
HSC1 和 HSC3 主要分布在control 和 TGF-β1组,SMC主要分布在TGF-β1组
综上:只有TGF-β1处理,能够产生肌成纤维细胞
图G-J:使用MAGIC进行基因表达量填充(因为单细胞数据很多缺失值),然后查看炎症和纤维化基因随时间变化趋势(G、J)和分布(H);


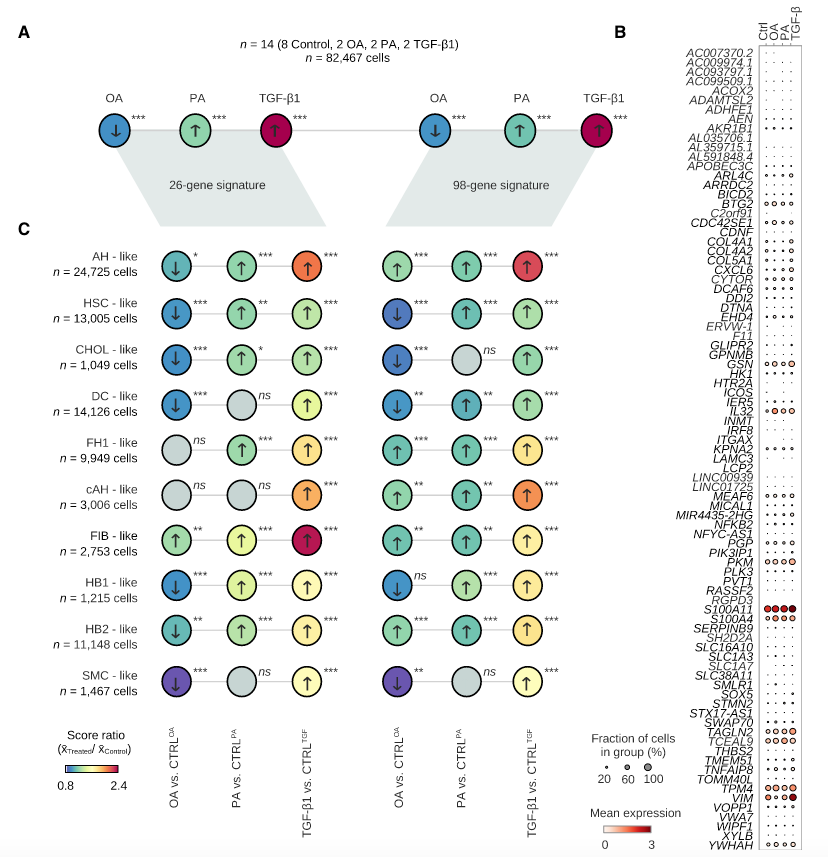
结果7:预测MASLD严重程度的基因特征评分从PA到TGF-β1逐渐增加,并显示出OA的混合反应
从文献中获取16和98个基因的fibrosis signature
图A:整体上比较处理组与control组相比这些基因的表达差异
图B:这些基因的表达点图
图C:每类细胞中比较处理组与control组相比这些基因的表达差异
综上:OA组中signature表达下降说明是MASLD进展有混合状态,AH-, cholangiocyte-, and HSC-like细胞无纤维化特证;PA 和 TGF-β1处理后逐步获得MASLD signature基因的表达;成肝细胞(HB)基因变化最大,
讨论
最好的培养方式是OS
3种处理适用于构建不同的模型
OA:模拟脂肪变性刚开始阶段
PA:脂肪性肝炎的炎症变化
TGF-β1:脂肪性肝炎和纤维化
缩写
MASLD:Metabolic dysfunction-associated steatotic liver disease 代谢功能障碍相关脂肪变性肝病
MASH:metabolic dysfunction-associated steatohepatitis 肝脏脂肪炎症,脂肪变性引起的炎症
NAFLD:non-alcoholic fatty liver disease 非酒精性脂肪肝
OA:oleic acid 油酸,单不饱和脂肪酸
PA:palmitic acid棕榈酸,饱和脂肪酸
HSC:hepatic stellate cells,肝星状细胞
本文来自互联网用户投稿,该文观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。 如若内容造成侵权/违法违规/事实不符,请联系我的编程经验分享网邮箱:chenni525@qq.com进行投诉反馈,一经查实,立即删除!