基于网络的HDAC6活性评估预测了乳腺癌对HDAC6抑制剂的反应
今天给同学们分享一篇实验文章“Network-based assessment of HDAC6 activity predicts preclinical and clinical responses to the HDAC6 inhibitor ricolinostat in breast cancer”,这篇文章发表在Nat Cancer期刊上,影响因子为22.7。

结果解读:
下一代HDAC6评分预测对HDAC6i的反应
由于作者之前的研究发现,对HDAC6功能的依赖与IBC中的高HDAC6评分相关,作者决定探索其作为HDAC6抑制剂敏感性的生物标志物的实用性。为了实现这个目标,作者首先评估了根据HDAC6评分分析预测为HDAC6i的乳腺肿瘤样本的比例,包括BRCA-TCGA和METABRIC数据集(约3,000个原发性肿瘤),以及癌细胞系百科全书(CCLE)中可用的BC细胞系集合(47个细胞系)(扩展数据图1a)。
原始的HDAC6调控基因组用于生成HDAC6评分是基于对359个BRCA-TCGA样本的基因表达谱的微阵列分析。然而,为了包括更多的数据集,包括更多异质性的肿瘤和不同的分析技术(即不同的基因表达谱微阵列平台和RNA-seq),需要对原始的HDAC6评分进行调整。因此,作者修订了用于计算HDAC6评分的原始调控基因组,使其与这些不同的技术和肿瘤模型保持一致。为此,作者使用了SJARACNe算法,该算法旨在从大量转录组谱中逆向构建基因调控网络(n > 100)。这生成了一个特定于乳腺癌的精细化HDAC6调控基因组,基于对BRCA-TCGA(RNA-seq,n=1,221)和METABRIC(微阵列,n=1,904)队列中所有可用基因表达谱的综合分析。作者还通过使用NetBID(数据驱动的基于网络的贝叶斯推断驱动因子)算法改进了HDAC6评分的计算。预期的是,尽管这些数据集之间存在明显的分析技术和样本准备协议的差异,但原始和更新的HDAC6调控基因组对HDAC6活性的预测强烈交集(p = 1.7E-33,扩展数据图1b和附表1)。此外,它们捕捉到了HDAC6的已知功能,例如未折叠蛋白应激(扩展数据图1c),并且与先前的研究结果一致,确认了IBC中较高的HDAC6活性水平(扩展数据图1d)。
使用更新的调控基因集,作者在上述三个数据集中测量了所有患者样本和细胞系的HDAC6得分。在这里,作者观察到所有原发性乳腺癌中约30%的样本的HDAC6得分高于IBC HDAC6得分的中位数,这表明对HDAC6抑制剂可能具有敏感性(扩展数据图1d)。有趣的是,高HDAC6得分在乳腺癌亚型中的分布不均,而是在HR+和HER2+的临床亚型(图1a)以及luminal-B和HER2富集的分子亚型中显著富集(扩展数据图1e)。这种关联在细胞系中也是明显的(图1b)。作者还想知道高HDAC6得分与HR+和HER2+乳腺癌亚型的关联是否在转移性乳腺癌中保持。METABRIC队列中没有转移性乳腺癌样本,而TCGA队列中只有7个。因此,作者利用转移性乳腺癌项目(MBC)中可用的数据来计算所有含有基因表达谱和IHC亚型信息的导管转移性乳腺癌的HDAC6得分(n=45)。值得注意的是,作者观察到这些转移样本中与原发乳腺癌(扩展数据图1f)中观察到的相同模式。

Ricolinostat在选定的细胞中显示出体内活性
尽管上述数据显示了瑞可利诺斯塔作为单一药物的抗癌活性,但在体内实现临床相关的反应通常需要将靶向治疗和标准化疗结合起来。乳腺癌的一线化疗通常包括使用蒽环类和紫杉醇类药物。因此,作者评估了将紫杉醇和多柔比星与瑞可利诺斯塔联合治疗的治疗价值。为此,作者使用了两种常用的方法:等效曲线法和组合指数(通过Chou-Talalay方程)。这两种分析表明,这两种化疗药物与瑞可利诺斯塔在瑞可利诺斯塔敏感细胞中具有协同作用(扩展数据图2d),但在瑞可利诺斯塔耐药细胞中没有协同作用(扩展数据图2d)。
为了将作者对MDA-MB-453和MDA-MB-436的研究转移到体内环境,这些细胞被注射到γ-SCID小鼠的侧腹作为小鼠异种移植物。在肿瘤生长到约100-150mm 3 时,它们被随机分配到几种治疗方案中的一种,包括单一药物ricolinostat和paclitaxel,以及ricolinostat与paclitaxel的联合治疗(组合)。由于paclitaxel被广泛用于乳腺癌的标准护理,最终选择了paclitaxel而不是doxorubicin。与体外结果一致,ricolinostat作为单一药物在MDA-MB-453的异种移植物中表现出显著的抗肿瘤生长活性,但在MDA-MB-436的异种移植物中没有表现出这种活性。通过测量经过治疗的动物的肿瘤提取物中的Ac-α-Tubulin和Ac-His-K27的WT-印迹,确认了该效应与特定的HDAC6抑制有关,对其他I类HDACs的影响很小。有趣的是,尽管在ricolinostat治疗期末(1个月)对敏感细胞仍可检测到小肿瘤,但与paclitaxel的联合治疗引起了完全反应(图2a)。经肿瘤内部评估发现,MDA-MB-453肿瘤中的ricolinostat反应与更高的凋亡水平(激活的Caspase-3)相关,而ricolinostat耐药的MDA-MB-436细胞则没有观察到这种效果(扩展数据图2e)。

利可林诺斯他与纳帕累计税醇的1b期试验
综合这些研究结果表明,BC中的ricolinostat敏感性与高HDAC6评分存在显著关联。为了将这一假设转化为临床背景,作者设计了一项开放标签的Ib期试验,使用ricolinostat与nab-紫杉醇联合治疗转移性乳腺癌(MBC)患者(图3a),这些患者在多个前期治疗线路上出现进展(附表3)。本研究的主要目标是确定ricolinostat与nab-紫杉醇联合应用的安全性、耐受性,并确定最大耐受剂量(MTD)和推荐的II期剂量(RP2D)。此外,次要目标是评估无进展生存期(PFS)、总体反应率(ORR)、临床获益率(CBR),并通过调查HDAC6评分与临床终点之间的相关性来评估HDAC6评分作为预测性生物标志物。

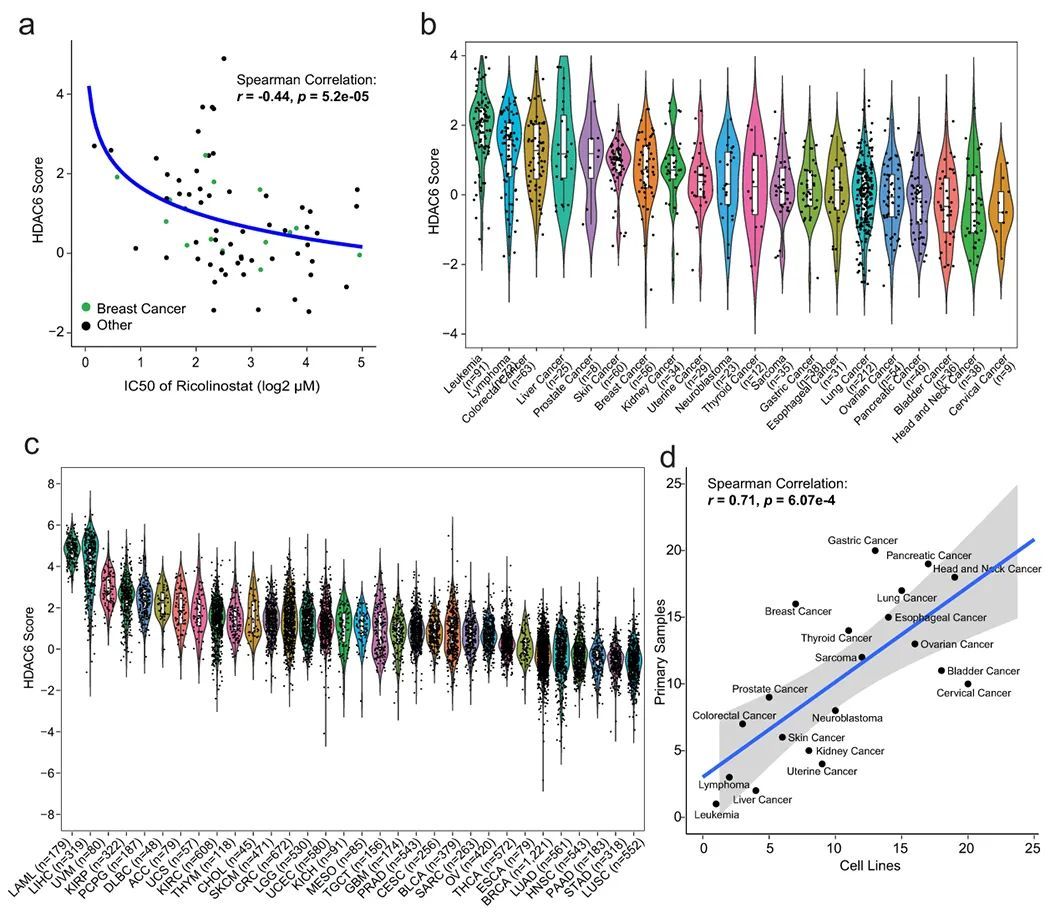
高HDAC6分数在各种人类癌症中被发现
由于作者的研究证实了HDAC6评分在人类患者中的预后价值,作者决定系统评估人类原发恶性肿瘤和癌细胞系中的HDAC6评分。具体而言,作者分析了超过10,000个基因表达谱,代表了TCGA数据库中的32种分子不同的人类恶性肿瘤(https://www.cancer.gov/tcga)。首先,作者使用与乳腺癌成功测试的相同方法生成了肿瘤特异性的HDAC6调控基因集,并用它们来按癌症类型特异性计算所有TCGA样本的HDAC6评分。如预期,不同肿瘤类型之间交集的基因数量非常显著,尽管也存在肿瘤类型特异性差异(扩展数据图6a和补充表10-11)。接下来,作者旨在调查HDAC-6评分与其他肿瘤类型治疗反应之间是否存在相关性。为此,作者进行了剂量-反应研究,评估了58个额外的癌细胞系中的ricolinostat IC50,代表了11种不同的肿瘤类型。值得注意的是,确认了乳腺癌特异性发现,HDAC6评分与IC之间存在显著的负相关(R = -0.44,p = 5.2E-5)(图4a;扩展数据图6b和6c,以及附表12)。最后,作者评估了CCLE队列中1156个不同癌细胞系的HDAC6评分,代表了20种肿瘤类型,以及32个原发性肿瘤(TCGA数据库)(图4b和4c,以及附表13)。作者还比较了癌细胞系和原发性肿瘤的HDAC6评分。作者使用了两个队列中都有数据的20种癌症类型,并分别按照HDAC6评分重新排名每种癌症类型。然后,作者在散点图中可视化了这20种癌症类型的排名,并采用Spearman方法计算了它们之间的相关性(图4d)。值得注意的是,作者观察到细胞系和原发样本之间的排名之间存在强相关性,显示了这两个队列中HDAC6评分分布的一致性,并支持使用细胞系来研究对HDAC6i的反应。
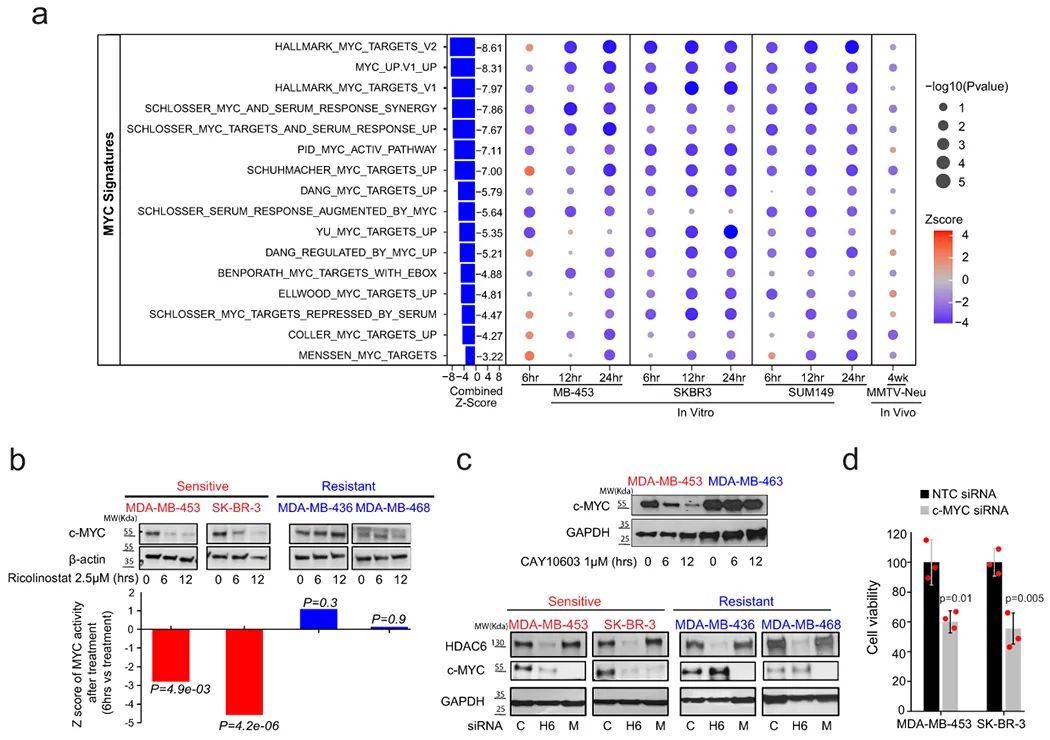
对于ricolinostat的反应与c-MYC的减少有关
为了研究响应ricolinostat的分子机制,作者比较了三个对ricolinostat敏感的细胞系以及经过ricolinostat处理12小时的MMTV-Neu肿瘤与对照组的转录谱。有趣的是,基因集富集分析(GSEA)显示,与MYC活性相关的标志物是ricolinostat处理的细胞中最显著下调的标志物(扩展数据图8a)。基于这个结果,作者通过在较早(6小时)和较晚(24小时)时间点对ricolinostat敏感的细胞系进行分析,并详细研究与MYC网络相关的所有标志物。在这里,作者发现在绝大多数MYC标志物中,MYC活性明显且强烈下降,即使在最早的时间点也是如此(图5a)。为了完成这些研究,作者还使用上述ARACNe算法推断了治疗期间的MYC活性。与GSEA研究一致,作者发现ricolinostat敏感细胞中MYC活性显著降低(扩展数据图8b)。在这些结果的推动下,作者比较了一系列对ricolinostat具有抗药性和敏感性的细胞系中MYC蛋白水平的表达(图5b)。这项研究揭示了ricolinostat敏感细胞系中MYC蛋白和活性的显著降低,而抗药细胞中基本保持不变(图5b和扩展数据图8c)。Myc活性和蛋白表达的丧失与一些细胞系中MYC mRNA的轻微减少有关,但在其他细胞系中没有(扩展数据图8d和8e)。当细胞接受其他HDAC6抑制剂治疗或通过RNAi沉默HDAC6时,预期观察到相同特异性的蛋白丧失(图5c)。
c-MYC是HDAC6的底物
只有少数HDAC6底物已被鉴定和验证。这些底物的乙酰化水平可以影响蛋白质的稳定性、活性或两者兼而有之。因此,作者决定进一步研究c-Myc是否可以成为HDAC6的底物。
首先,作者进行了共免疫沉淀(co-IP)实验,研究c-Myc和HDAC6之间是否存在物理相互作用。简而言之,鉴于c-Myc的半衰期较短(约30分钟) 36 ,作者将HEK-293T细胞转导为表达更稳定形式的c-Myc构建体(带有突变的降解域 37 ),并在强力霉素(dox)诱导条件下进行。在dox诱导后,作者检测到HDAC6和c-Myc之间明确的直接相互作用,并观察到使用HDAC6抗体时c-Myc的共免疫沉淀以及使用c-Myc抗体时HDAC6的共免疫沉淀(图6a)。为了补充作者的研究并获取HDAC6影响的潜在氨基酸残基信息,作者进行了串联质谱标记(TMT)蛋白质组学实验,比较了在失活HDAC6之前和之后乙酰化蛋白质的谱图。为此,作者首先使用CRISPR技术生成了HAP1细胞的敲除(KO)和HDAC6突变体(H651A),该细胞系被选择为单倍体模型,便于通过同源重组生成点突变体(图6b)。组氨酸651的突变被选择,因为已经证明其与配体结合的亲和力降低了150倍。与对照的野生型细胞相比,预期的HDAC6突变体表现出了α-微管乙酰化水平的升高(图6b)。对于TMT研究,HAP1变异体经过处理以获得蛋白质提取物。然后通过免疫沉淀提取乙酰化蛋白质,最后进行定量(图6b)。该研究能够定量分析1618种蛋白质中的3359个乙酰化位点(附表14)。其中,57个位点在HDAC6-KO细胞中乙酰化显著增加(FDR<0.05;折叠变化>1.5);其中49个位点(86%)在H651A突变体中也显著增加(FDR>0.05)。有趣的是,c-Myc在Lys148(K148)的乙酰化也是该列表中的一个重要位点,显示出显著增加(FDR<0.05;折叠变化>1.5),在HDAC6-KO和突变体中都如此(图6b和扩展数据图9a)。值得注意的是,TTC5和EP300乙酰转移酶对该位点的乙酰化与蛋白酶体介导的c-Myc降解相关。

总结
作者在这里呈现的研究表明,ricolinostat在富含HR+和HER2+特征的多种乳腺癌中也具有活性。作者的临床研究是一个早期试验,入组患者在开始治疗前已经经历了多种治疗线路的疾病进展。尽管是一个经过重度预处理的队列,作者患者的临床获益率为31.25%。因此,作者的研究提供了初步证据,支持在已经耗尽标准治疗选择的患者中使用ricolinostat加nab-紫杉醇。值得注意的是,该组合疗法的活性也观察到了之前在紫杉醇治疗后出现进展的患者中。
本文来自互联网用户投稿,该文观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。 如若内容造成侵权/违法违规/事实不符,请联系我的编程经验分享网邮箱:chenni525@qq.com进行投诉反馈,一经查实,立即删除!
- Python教程
- 深入理解 MySQL 中的 HAVING 关键字和聚合函数
- Qt之QChar编码(1)
- MyBatis入门基础篇
- 用Python脚本实现FFmpeg批量转换
- 杭州悦数成立「悦数图技术陆家嘴数据智能研究院」入驻上海「双城辉映」平台
- Mybatis-Plus扩展(进一步探索Mybatis-Plus的功能)
- 这个零售行业销售工具,老板都惊呆了!
- C语言-回溯法-地图着色问题
- 再也不怕合照缺人,Anydoor为图片编辑开了一道「任意门」
- 数据结构---队列(Queue)
- 分析C++软件问题的常用分析工具及案例集锦详解
- CSAPP《深入理解计算机系统》深读笔记2——第二章-信息的表示和处理(上)
- jQuery框架
- LeetCode面向运气之Javascript—第66题-加1-99.78%