炎症状态重塑了急性髓系白血病的免疫微环境并改善了风险分层
今天给同学们分享一篇实验文章“An inflammatory state remodels the immune microenvironment and improves risk stratification in acute myeloid leukemia”,这篇文章发表在Nat Cancer期刊上,影响因子为22.7。

结果解读:
成人和儿童AML的恶性和免疫景观
为了研究成人和儿童AML的骨髓免疫微环境,作者对来自健康供体的十个骨髓样本进行了单细胞RNA测序(年轻供体,中位年龄20岁(范围19-26岁)和年长供体,中位年龄47岁(范围39-53岁);共计50,244个细胞),对成人AML患者的20个诊断性骨髓抽吸样本进行了测序(中位年龄68.5岁(范围32-84岁);共计89,733个细胞),以及对儿童AML患者的22个诊断性骨髓抽吸样本进行了测序(中位年龄7.4岁(范围2个月至21岁);共计74,440个细胞)(附表1)。统一流形近似和投影(UMAP)显示,成人和儿童AML的骨髓发生了重塑,一些亚型在健康和AML骨髓中交集,而一些亚型则主要由成人或儿童AML细胞主导(图1a)。为了开始描述AML中骨髓免疫微环境的变化,作者根据细胞的转录谱和细胞表面蛋白表达进行了细胞注释(图1b,扩展数据图1a和附表2)。AML患者中特定亚群的造血干细胞和祖细胞(HSPCs)数量增加,包括造血干细胞、多能祖细胞和粒-单核细胞祖细胞(扩展数据图1b)。髓系细胞群体基本保持不变,但个别患者特定髓系细胞类型扩增(扩展数据图1c)。在淋巴系谱系中,AML患者的前B细胞和前原B细胞严重减少,儿童AML患者的浆细胞爆发和浆细胞也减少(扩展数据图1d)。儿童患者的CD4 + 和CD8 + T细胞也减少,而粘膜相关固有T细胞(MAIT细胞)和自然杀伤细胞(NK细胞)在成人和儿童患者中均减少(扩展数据图1e)。总体而言,这项分析表明AML患者的骨髓免疫微环境发生了明显改变,可能对疾病进展产生潜在影响。
成人和儿童AML中的炎症基因特征
为了表征AML进展的致病过程,作者对健康和恶性HSPC和髓系细胞进行了非负矩阵分解(NMF)和差异表达分析。在NMF中鉴定出的常见基因表达谱包括细胞类型特异性以及不同的细胞程序。恶性细胞显示出富集于细胞周期、RNA剪接、未折叠蛋白应激、代谢过程和炎症的程序表达(扩展数据图5a,图2a-c和补充表3)。进一步的差异表达分析,将恶性细胞的不同亚群与健康供体中相应的细胞进行比较(恶性HSPC样细胞与健康供体HSPC进行比较,恶性髓系样细胞与健康供体髓系细胞进行比较),揭示了与炎症过程相关的一些基因的异常表达,包括II类抗原呈递(HLA-DRA,HLA-DMA,HLA-DPB1和HLA-DPA1),S100报警蛋白(S100A6,S100A4和S100A12),趋化因子(CXCL8)和干扰素应答基因(IRF2BP2,ISG15,IFI44L和IFI27)(图2d,e和补充表4)。为了进一步研究炎症在AML中的作用,作者生成了成人特异性和儿童特异性的炎症特征,包括成人或儿童患者恶性细胞中发生异常调控的与炎症相关的基因。尽管儿童和成人的炎症特征包含类似的途径(扩展数据图6a和补充表5和6),但只有95个基因在这些特征之间交集(扩展数据图6b),与已知的儿童和成人AML患者的肿瘤基因组学和免疫系统成熟度差异一致。然而,尽管大部分个体炎症相关基因存在差异,儿童和成人患者之间共享的途径激活表明炎症免疫反应是AML中的一个重要因素,存在于整个白血病患者的年龄范围内。

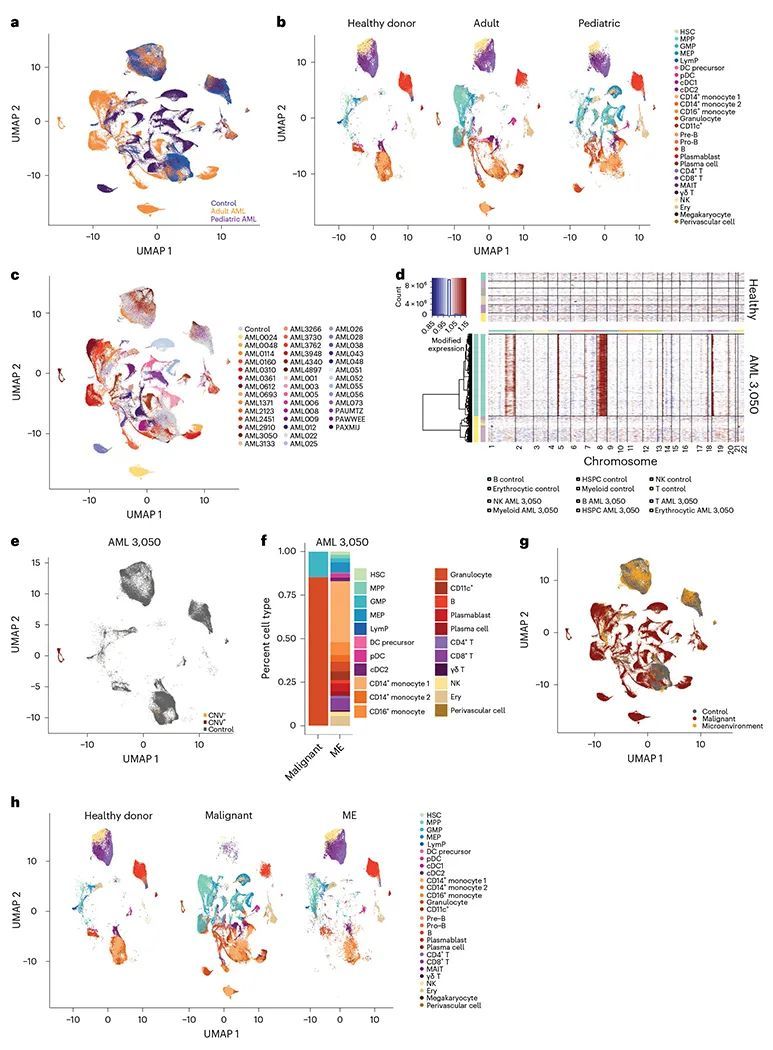
非典型B细胞与AML中的炎症相关
分离恶性和骨髓细胞使作者能够研究炎症对AML免疫微环境的影响。为了调查AML免疫微环境的变化,作者将重点放在骨髓中的淋巴细胞系谱上。最初,作者对B细胞进行了聚类,并根据转录组和表面蛋白表达进行了不同种群的注释(图3a,扩展数据图7a,b和补充表7)。值得注意的是,一部分B细胞,即非典型B细胞(表达ITGAX,FCRL3和FCRL5;补充表7),在成人和儿童AML患者中富集(图3b和扩展数据图7c)。由于非典型B细胞常见于慢性或复发感染的患者中,作者检查了它们在高炎症AML患者中是否更丰富。对Alliance队列、癌症基因组图谱(TCGA)和TARGET-AML儿科队列的分析表明,非典型B细胞基因特征与成人和儿童AML患者的炎症状态高度相关(图3c和扩展数据图7d),表明这些细胞特异性富集于高炎症AML患者中。
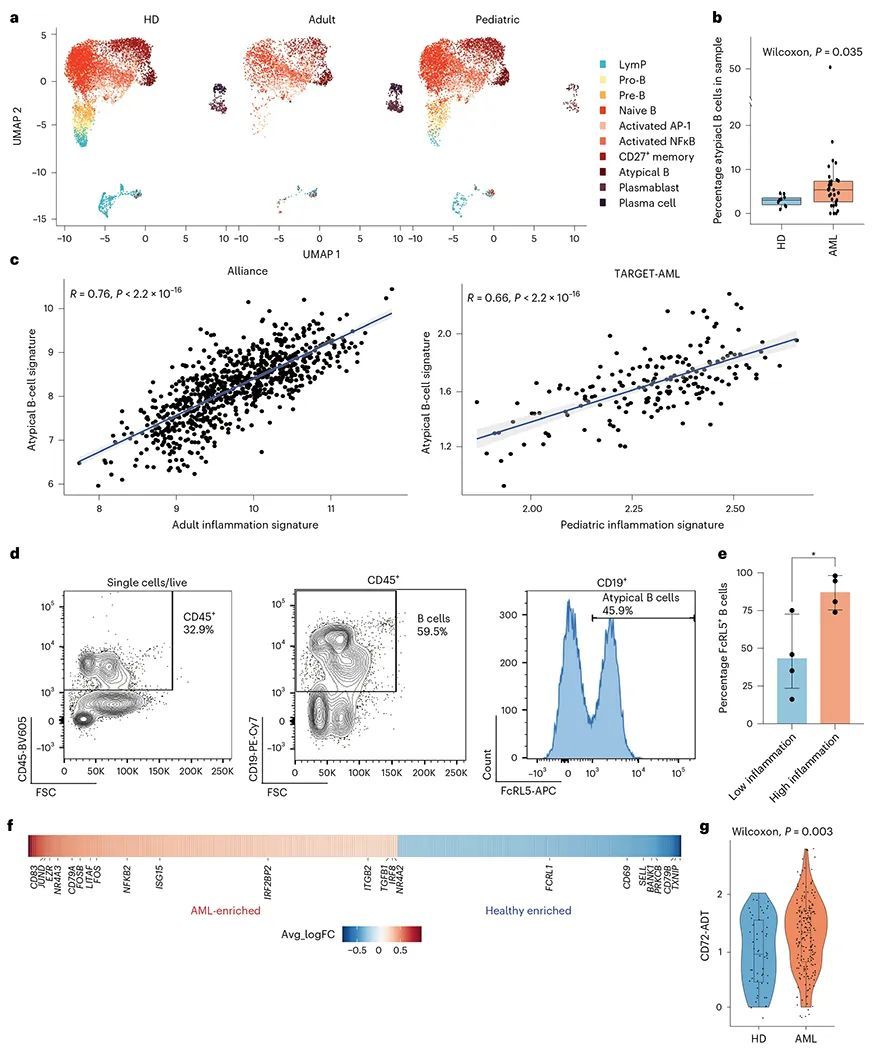
高炎症和低炎症AML中的T细胞反应分歧
作者接下来试图对AML中的T细胞和NK细胞进行表征。作者根据它们的转录组和表面蛋白表达(图4a,扩展数据图8a,b和补充表9)对T细胞和NK细胞进行了注释,并在骨髓中量化了不同的亚群。先前有报道称,在AML患者中,细胞毒性CD8 + T细胞减少,调节性T reg 细胞增多。在单细胞队列中,作者并未观察到成年或儿童患者中细胞毒性或T reg 细胞亚群的显著变化,尽管细胞毒性T细胞在患者的骨髓中略有扩增(图4b,c)。已知炎症会影响实体肿瘤中的T细胞群体,并且在这种情况下,被认为患有炎症的肿瘤更具免疫原性。因此,作者试图研究炎症对AML中T细胞群体的影响。虽然在成年患者中,作者没有观察到高炎症和低炎症患者之间的显著差异(扩展数据图8c),但在儿童患者中,炎症患者中的T reg 细胞和GZMK + CD8 + T细胞显著扩增(图4d,e)。e)。先前已经显示,GZMK + CD8 + T细胞是终末耗竭的CD8 + T(T pex )细胞的前体,这些细胞会定向到炎症部位,并且被认为对免疫检查点阻断疗法有反应 42,43 。在作者的数据集中,GZMK + CD8 + T细胞表达了T pex 细胞的基因特征,包括几个耗竭标记物(PDCD1、TIGIT和TOX;图4f)。总体而言,这些数据表明,在高炎症的小儿AML患者中,T细胞反应被抑制。
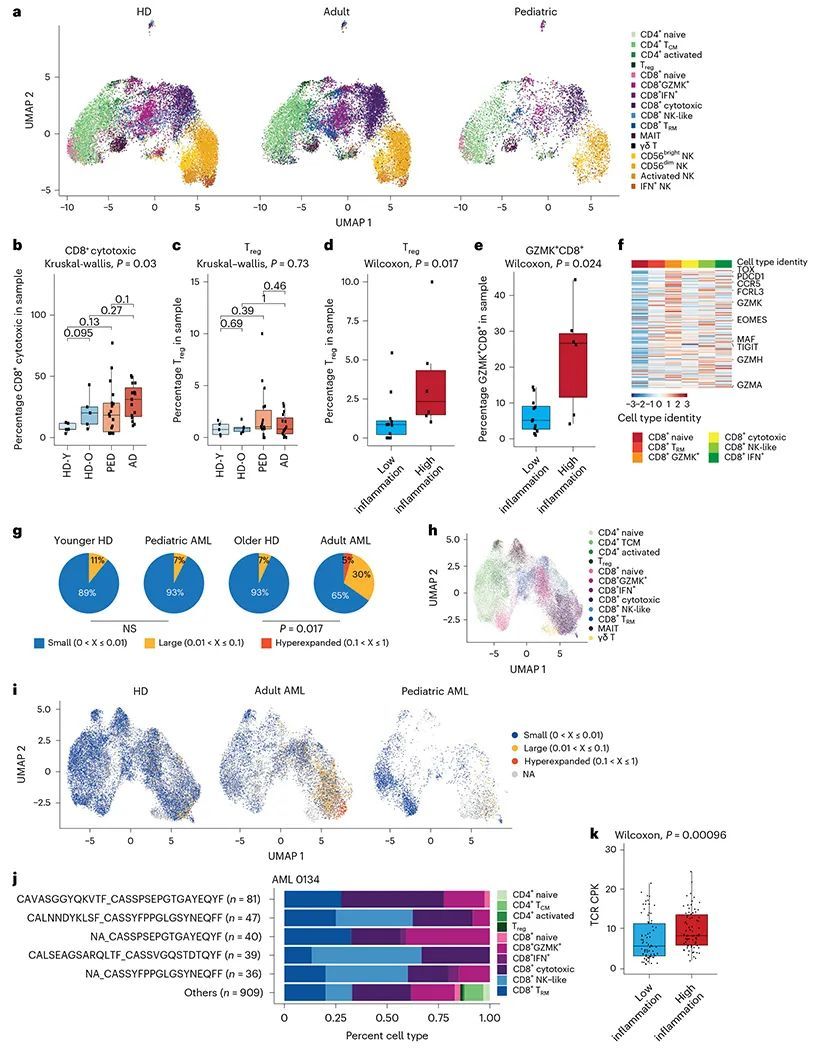
AML的炎症临床意义
为了研究炎症对患者预后的影响,作者检查了炎症标志基因与成人和儿童患者的总体生存率(OS)之间的关联。在成人患者中,78个基因和116个基因(分别占31.7%和47.1%)与OS呈负相关(对于<60岁和≥60岁的患者),而在儿童患者中,63个基因(占33.8%)与OS呈负相关,这表明炎症基因标志的一个子集在AML中具有预后价值(附表10)。为了更好地研究炎症与生存的关联,作者计算了一个炎症风险评分,该评分结合了每个基因的Cox回归β系数值。高炎症风险评分与成人和儿童患者的降低OS相关(扩展数据图9a,b)。接下来,作者使用稀疏回归分析将儿童和成人患者的炎症基因集合减少,以生成临床可应用的基因标志,使用成人(Alliance)和儿童(TARGET-AML)患者的批量RNA-seq队列中的炎症基因标志。这导致了38个和11个核心炎症基因,分别代表成人和儿科患者与炎症基因相关的生存风险(iScore)(附表11),在两个队列以及所有风险分层中都有连续分布(扩展数据图9c, dd)。
为了进一步描述与较高或较低iScores相关的分子特征,作者比较了已知的AML相关分子亚型中的iScore水平。成人和儿童的批量RNA-seq数据使用基于每个队列中最可变基因的相关性的t分布随机邻域嵌入(t-SNE)进行可视化,结果显示出反映患者转录身份和突变谱的聚类(图5a,b)。在AML患者的儿童和成人中,作者观察到iScore与特定的分子驱动因子和转录身份特征之间的强关联(图5c,d)。具体而言,低iScore与有利的分子特征(如inv(16)AML(P < 0.001成人和儿童队列)、NPM1突变(P < 0.001成人队列,P = 0.08儿童队列))之间存在强关联。相反,已建立的分子不良预后因子,如复杂核型(P < 0.001成人队列)、CBFA2T3-GLIS2(P < 0.001儿童队列)、FLT3-ITD(P < 0.001成人队列)、RUNX1(P < 0.001成人队列)和TP53突变(P < 0.001成人队列)与高iScore相关(附表12)。值得注意的是,尽管与已知的分子驱动因子和已建立的结果预测因子有强烈的关联,但iScore在成人和儿童患者中都具有附加的预后价值。在成人患者中,高iScore在其他临床预后参数(如干细胞特性(LSC17得分 45 ))的背景下具有独立的预后影响,无论是年轻患者还是老年患者(扩展数据图9e)。在考虑儿童AML患者时,炎症状态的考虑除了已建立的临床参数(如致癌驱动因子、转录标识符和LSC6干细胞特性得分 46 )外,还提供了独立的预后信息(扩展数据图9f)。
总结
总之,作者提供了AML骨髓免疫微环境的独特概述。作者证明了炎症在塑造AML微环境中起着重要作用,并确定了在高炎症AML患者中独特扩增的免疫细胞群体。作者描述了一个与炎症相关的基因特征(iScore),在AML中具有独立的预后影响。作者建议根据患者的iScore对AML进行分层,以提高AML的风险分层。
本文来自互联网用户投稿,该文观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。 如若内容造成侵权/违法违规/事实不符,请联系我的编程经验分享网邮箱:chenni525@qq.com进行投诉反馈,一经查实,立即删除!
- Python教程
- 深入理解 MySQL 中的 HAVING 关键字和聚合函数
- Qt之QChar编码(1)
- MyBatis入门基础篇
- 用Python脚本实现FFmpeg批量转换
- Python基础中的列表知识整理归纳
- ?这么多选择,为什么要买一台高山 MPV?
- UML-类图和类图转化为代码
- C++入门【30-C++日期&时间】
- ::v-deep深度作用选择器实现Vue组件样式穿透
- vue2使用svg图片
- Kafka-Kafka核心参数详解
- CDH 6.3启动失败,由于日志写入权限原因导致cloudera-scm-server.log未生成
- Inscribe:应用非定向资产交易协议 布局巨大铭文赛道
- 小红书青年文化洞察:新“旷野文学”兴起,用户回归人间清醒?