Nat Med | 白血病患儿持续存在CD19 CAR-T细胞的转录特征

结果解读:
研究队列和实验概述
作者研究了15例高危或复发的CD19 B-ALL患者,这些患者接受了CD19 CAR-T细胞疗法,研究名称为CARPALL(NCT02443831)。作者从冷冻保存的血液或骨髓样本中分离出足够的CAR-T细胞进行后续分析。前14例患者的治疗结果已经报道;随后又治疗了另外18例患者。研究发现,15例患者中有13例(87%)达到了完全缓解;其中6例患者后来复发,而另外7例患者通过可检测到的CAR-T细胞和伴随的B细胞减少维持了长期缓解(图1a)。作者对11例患者进行了详细的流式细胞术表型分析,并从10名儿童中获取了足够的CAR-T细胞进行单细胞mRNA和T细胞受体(TCR)测序(73个患者样本分为89个基因表达(GEX)/TCR和64个流式样本;扩展数据图1)。样本分别来自CAR-T细胞产品以及患者在早期(1-3个月)、中期(4-6个月)和晚期(7个月及以后)的时间点。早期时间点被定义为1-3个月,因为所有达到分子完全缓解且无可测量残留疾病的患者都是在这个时间窗口内实现的。晚期时间点是根据CD19 ? 复发的时间选择的,这些复发通常是早期事件,并且在第7个月之前就会发生。中期时间点是早期和晚期之间剩余的时间间隔。两名患者在所有时间点(早期、中期和晚期)都有产品样本;四名患者有所有输注后时间点的样本;两名患者在三个输注后时间点中有两个时间点的样本;两名患者由于早期复发只有早期时间点进行了调查。作者通过流式细胞术使用CD3和CAR表达从外周血或骨髓中分离CAR-T细胞,然后进行单细胞测序(Chromium 10x平台)(图1b)。


双阴性CAR-T细胞勾勒出晚期时间点
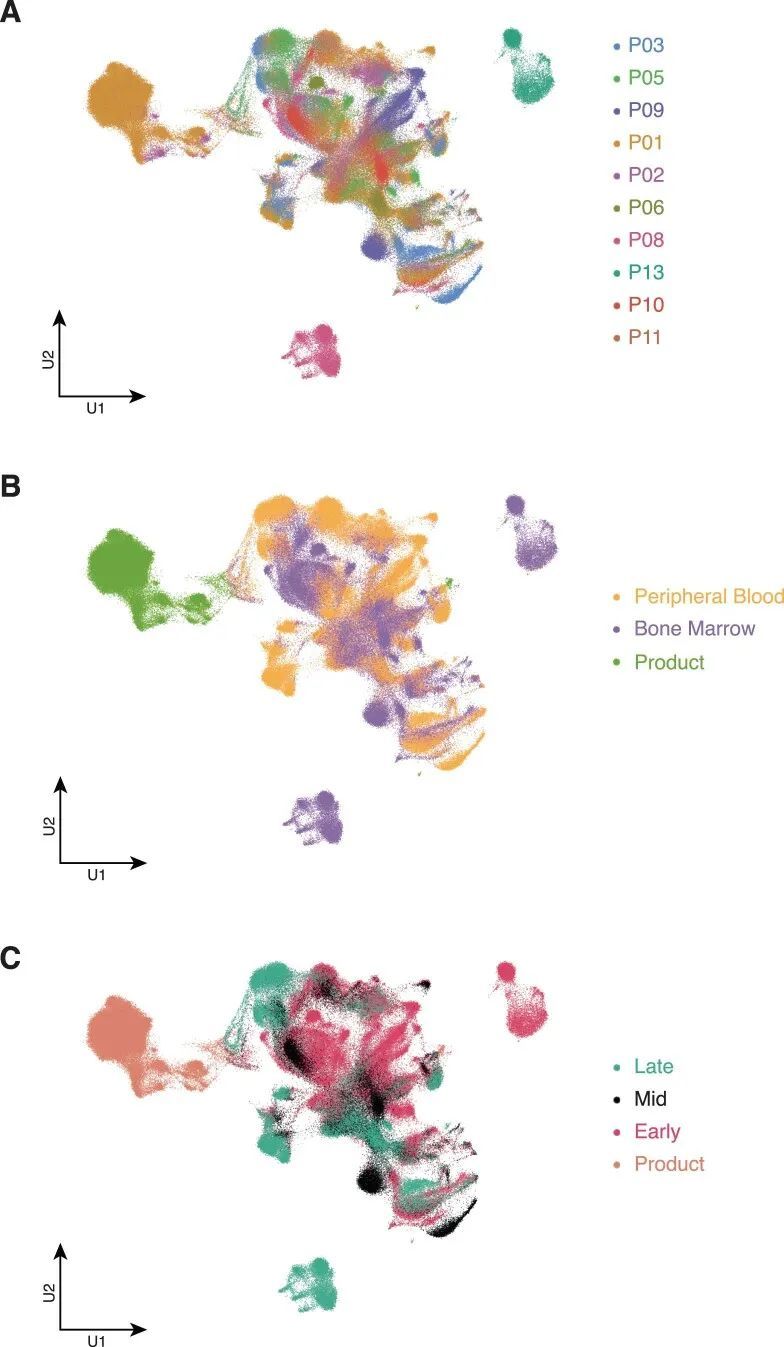
总共,作者恢复了264,827个通过质量控制的单个细胞,其中大约有50,000个是CAR-T细胞。作者使用常用的分析方法对所有264,827个细胞进行了分组,并使用统一流形逼近和投影(UMAP)可视化了结果聚类(图1c和扩展数据图2)。聚类将CAR-T细胞与非CAR-T细胞分开,所有患者都有贡献。两个聚类完全是患者特异性的;这些聚类代表了两个儿童(患者P13和P08)在采样时CD19 ? 复发的所有癌细胞。CAR-T细胞的亚聚类将细胞在输注产品中在月份0(M0)时分开,然后是早期(M1-3),中期(M4-6)和晚期(M7-60)输注后的时间点(图2a)。来自所有时间点的细胞聚集在一起,表明CAR-T细胞在输注后几年仍具有增殖能力。使用基于标记的注释,CD8 + T细胞在大多数情况下在所有时间点上都是主要的CAR-T细胞,除了在晚期时间点,CAR-T细胞缺乏CD4和CD8A转录物的表达(图2b,扩展数据图3)。在这一点上,CD4 CAR-T细胞只做出了较小的贡献。因此,晚期或持续存在的CAR-T细胞群体主要是双阴性T细胞。
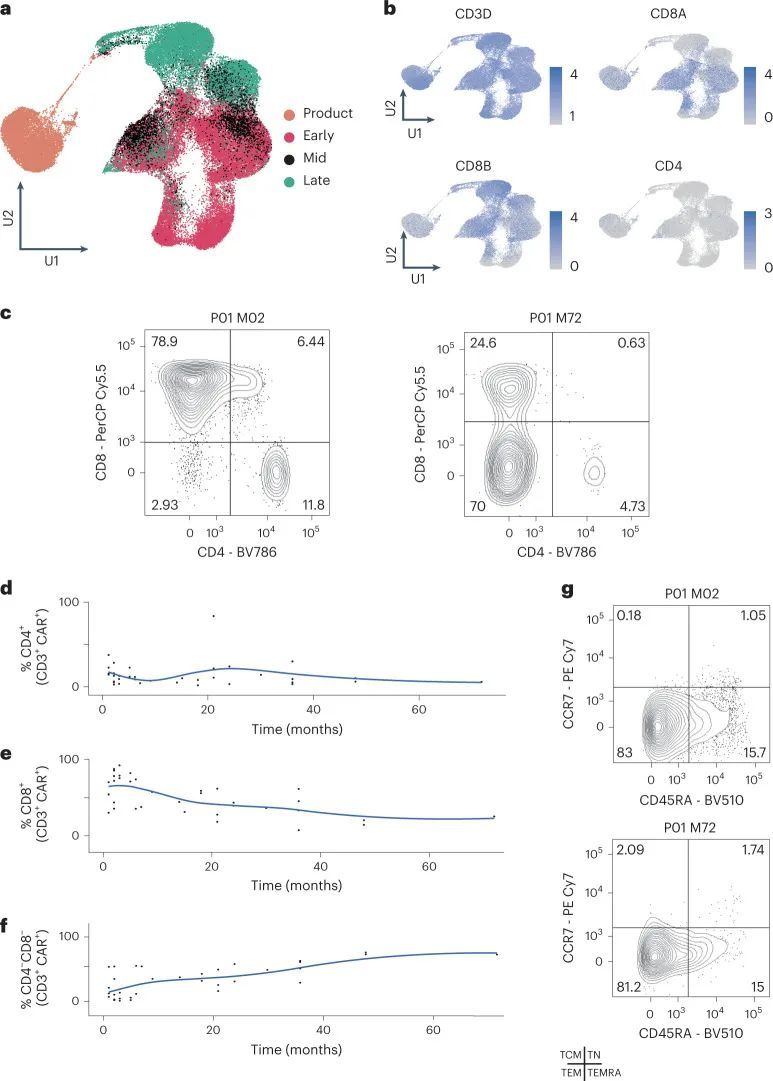
双阴性CAR-T细胞状态的验证
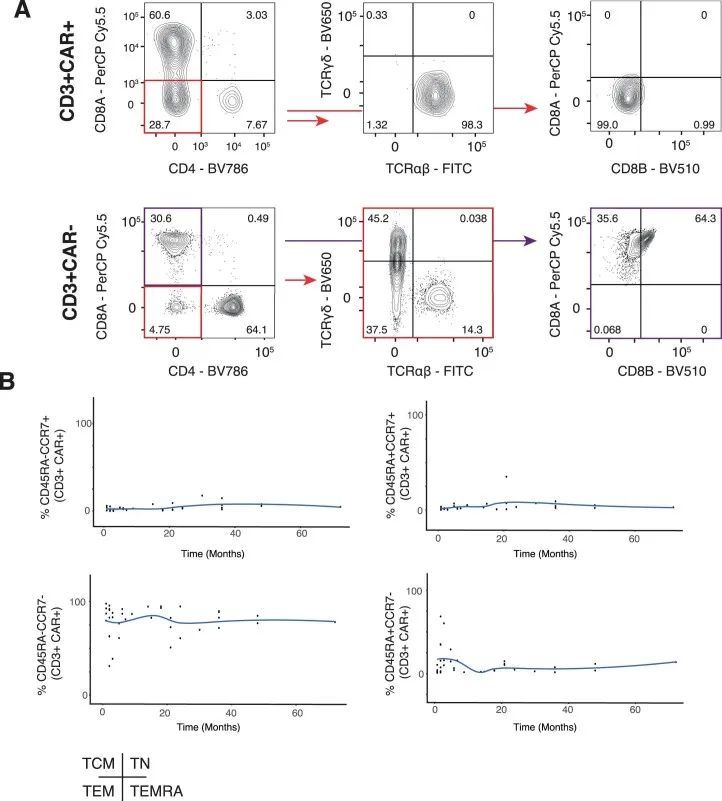
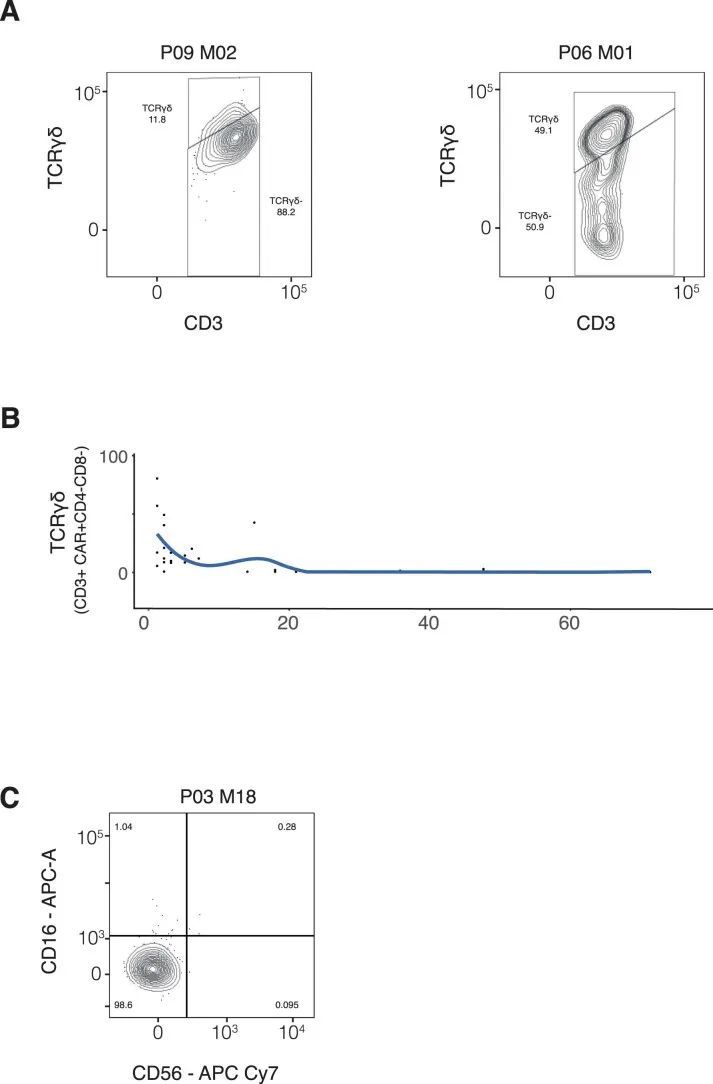
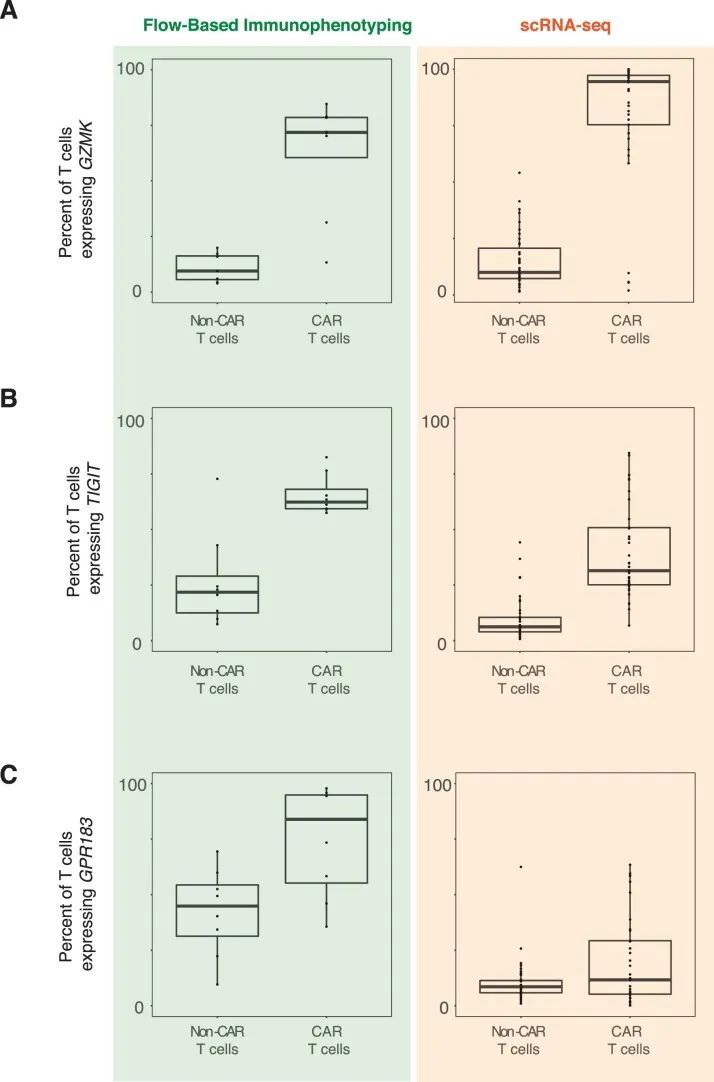
为了确认CD8亚群的早期优势和双阴性人群的后期出现,作者采用了两种正交方法。首先,作者通过流式细胞术分析了来自七名CARPALL患者的外周血(PB)和骨髓(BM)样本,这些样本是在输注后的较晚时间点收集的(输注后7-72个月)。作者使用CD3表达和针对CAR特异性的抗独特抗原抗体来鉴定CAR-T细胞,并评估CAR-T细胞上CD4和CD8的表达情况(图2c-f和扩展数据图4a)。这项分析确认了在这些较晚时间点,大多数细胞都是双阴性的,CD8 T细胞的贡献较小。与此相反,在这些患者的非CAR-T细胞组分中,双阴性T细胞的比例较低。此外,CAR-T细胞还特征为不表达CD45RA和CCR7,表明其具有效应记忆表型(图2g和扩展数据图4b)。
在作者的第二种方法中,作者追求了一种与细胞标记无关的分析方法,将细胞身份分配给CAR-T细胞。作者直接将CAR-T细胞转录组与循环人类免疫系统的多模态单细胞图谱进行了比较。该参考基于通过单细胞mRNA测序和228种抗表面蛋白抗体(CITE-seq)对211,000个人类血液单核细胞进行了研究。与作者最初的注释和流式细胞术的蛋白验证一致,作者观察到大多数持续存在的CAR-T细胞被分类为双阴性细胞,而较早时间点的CAR-T细胞主要是CD8 T细胞(图3a,b)。例外情况是P09和P06患者,他们的早期CAR-T细胞中有相当数量的双阴性γδ T细胞,这些细胞高表达NKG7和GNLY(扩展数据图图5)。这与先前的报告一致,即γδ T淋巴细胞与CD8 T细胞和自然杀伤(NK)细胞具有相似性。综上所述,作者的初步观察并通过两种方法进行验证表明,大多数持续存在的CAR-T细胞代表双阴性αβ T细胞。
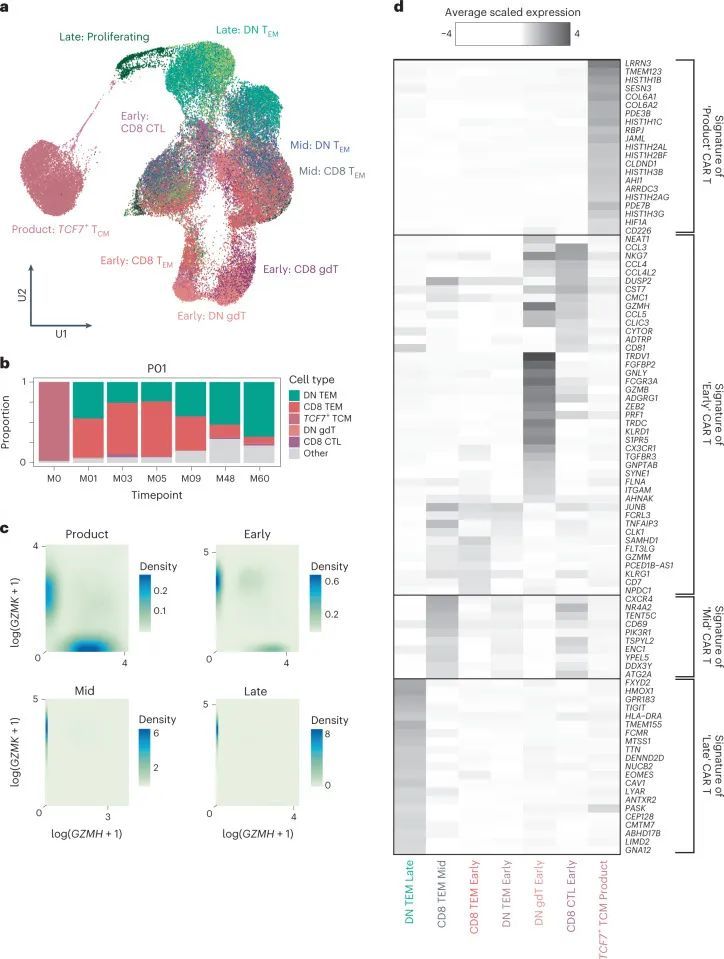
持续的CAR-T细胞表现出转录特征
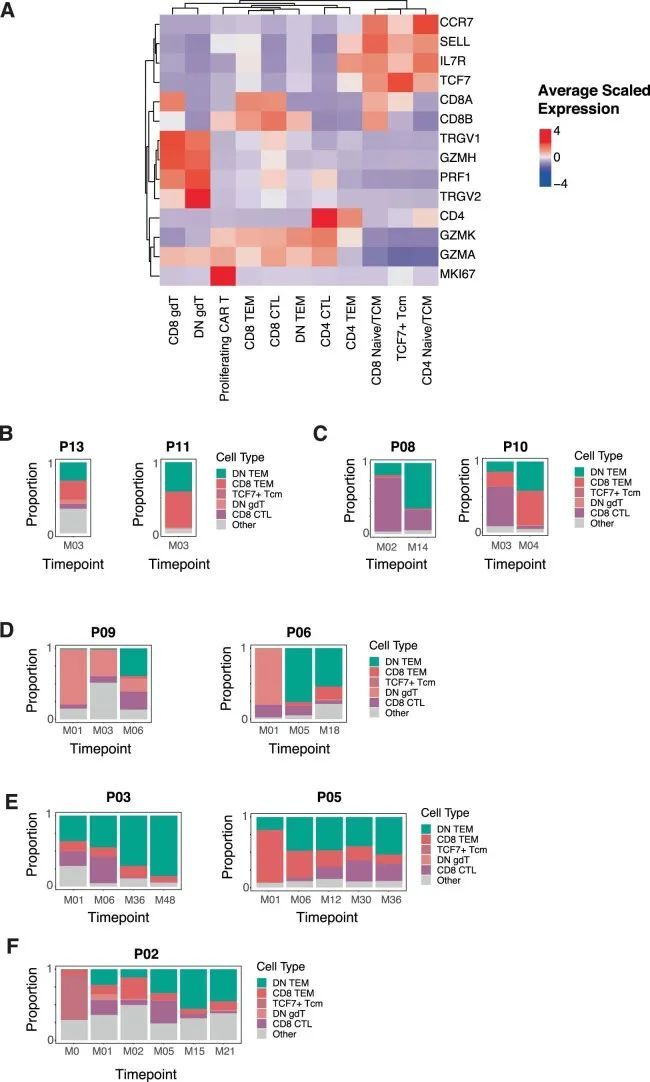
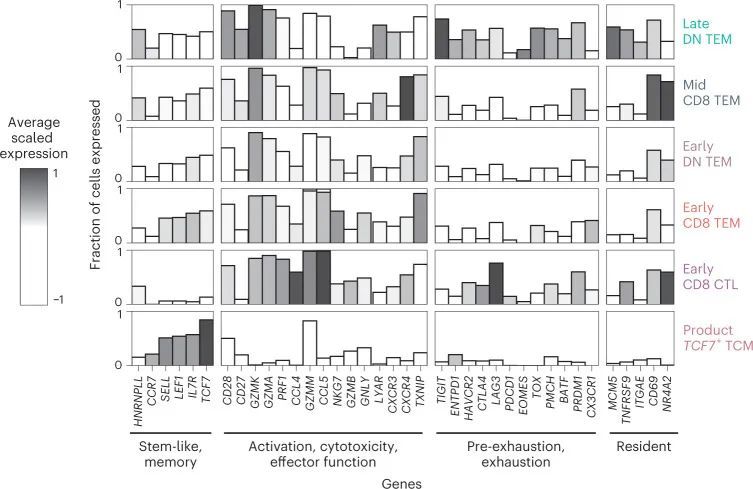
接下来,作者确定了不同时间点CAR-T细胞中的差异表达基因,以提取输注、早期、中期和晚期CAR-T细胞的标记物。输注产品富集了与细胞周期、核小体组装和糖酵解相关的基因,可能是由于体外制造过程中的激活作用。输注产品表达了与天然淋巴细胞(如SELL、CCR7、IL7R和LRRN3)和早期记忆分化状态(如TCF7和LEF1)相关的基因的高水平。输注后CARPALL CAR-T细胞的主要基因表达模式在颗粒酶基因表达的连续性上被定义(图3c)。在输注后的时间点上,CAR-T细胞倾向于高GZMH和GZMB表达或高GZMK表达。通过高GZMK表达定义的CAR-T群体还表达了与效应子(LTB)、记忆(CD27和IL7R)和激活(CD28)功能相关的基因,而GZMH + GZMB + 细胞则表达了FGFBP2和ZEB2。与本研究中的其他患者不同,除了P09之外,大多数晚期时间点的CAR-T细胞表达了GZMK。在非CAR-T细胞中,也观察到了GZMH/B-GZMK表达模式;然而,CAR-T细胞表达的GZMK水平要高得多(扩展数据图6a)。最常见和最强的晚期CAR-T细胞标记物形成了一个持久的CAR-T特征,其特征是通过真正的免疫相关基因(如TIGIT和GPR183)以及在免疫生物学中具有未知或新兴作用的基因(图3d和扩展数据图6b、c)来界定的。后者包括FXYD2、HMOX1、DENND2D和ISG20等基因。这种细胞群体的顶级标记物是FXYD2,它编码了Na + /K + ATPase通道的调节因子。值得注意的是,FXYD2是功能上隐蔽的CD34 low CD3 ? CD4 + CD8 ? 胸腺内T前体细胞中的转录本之一,这些细胞在人类胸腺中已有描述。总的来说,作者的数据揭示了在患者内部和患者之间,成千上万的CAR-T细胞趋于一个双阴性细胞表型,显示出共同和独特的基因特征。
近年来,关于记忆细胞和疲劳T细胞之间二分法的经典观念受到了挑战,因为功能活跃的记忆细胞被发现带有先前疲劳的痕迹。在持久性特征中,最高表达的基因之一是疲劳标记物TIGIT。因此,作者评估了作者的CAR-T细胞中疲劳标记物的共表达情况。作者发现晚期CAR-T细胞表达了经典的共抑制受体,如HAVCR2和LAG3,但PDCD1的表达程度较低(图4)。因此,作者对与疲劳和前体疲劳T细胞相关的这些介质的基因和匹配的蛋白表达(流式细胞术)进行了研究(扩展数据图7a)。前体疲劳T细胞已在人类癌症中分离出来,其存在与免疫疗法的反应相关。与前体疲劳T细胞类似,晚期CAR-T细胞表达了相关的效应基因,如GZMK和PRF1,以及与T细胞疲劳相关的转录因子,包括TOX、NFATC1、BATF和PRDM1。尽管表现出疲劳的特征,但晚期CAR-T细胞并未呈现终末分化的状态,这得到了B3GAT1(CD57)的低表达和流式细胞术中表达不超过两个疲劳标记物的支持(扩展数据图7b)。与作者评估的产品中的CAR-T细胞不同,晚期CAR-T细胞并未高水平表达TCF7,而TCF7在其他情境中协调前体疲劳T细胞的记忆干细胞状态。然而,相反地,JUN的表达强烈,JUN是与AP-1相关的转录因子,可以介导T细胞疲劳的逆转和维持具有干细胞记忆特性的细胞。因此,尽管长期存在的CAR-T细胞并未完全模拟先前描述的前体疲劳T细胞群体,但从转录和流式细胞术的角度来看,这种细胞类型最能描述它们的效应记忆、疲劳印记状态。

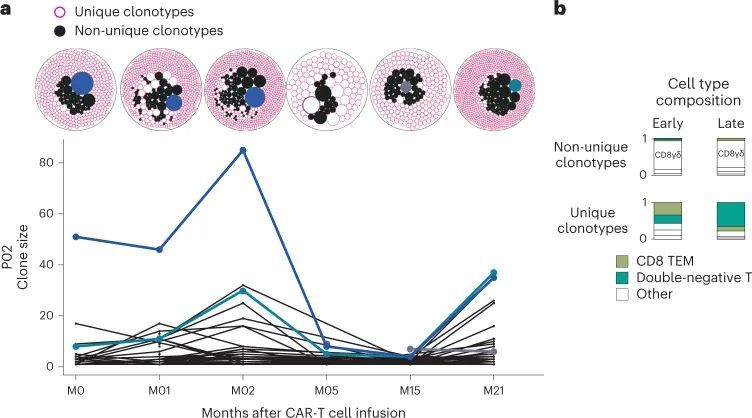
持续存在的CAR-T细胞的多克隆群体结构
在每个患者中,作者观察到,无论T细胞亚群如何,成千上万的细胞在后期时间点上趋于相同的转录状态,这引发了一个问题,即特定克隆的扩增是否支撑了这种功能性的趋同。因此,作者对CAR-T细胞的TCR序列进行了调查,并从89个样本中获得了88个样本的基因表达数据(扩展数据图1)。作者发现,无论时间点如何,绝大多数细胞都携带着在其他时间点未观察到的独特克隆型。这表明底层基因库保持足够多样化,以防止捕获和追踪个体克隆(图5a和扩展数据图8a、b)。这种分析的一个重要考虑因素是CAR-T细胞的频率随时间减少,因此在后期时间点,循环血液中CD3细胞的频率可能仅为总数的0.05%(扩展数据图8c)。尽管如此,如果人群结构是单克隆的,作者将在每次采血中捕获相同的克隆。在少数可追踪的克隆型中,早期时间点的前10个克隆型在后期时间点仍然属于相对多数,但随着时间的推移频率逐渐降低。作者观察到克隆型之间的细胞类型组成存在广泛的变异,无论它们是独特的还是跨时间点观察到的。跨时间点观察到的克隆型主要是CD8 + T细胞,而独特的克隆型倾向于是双阴性T细胞(图5b和扩展数据图8a,b)。对于两位患者(P02和P01),作者拥有输注产品TCR数据,作者能够追踪到分别占1.7%和0.5%的克隆型从输注产品到2年和5年的时间。总体而言,这些克隆结构表明,在所有时间点,CAR-T细胞群体在基因上是多样的,与先前对CARPALL CAR-T细胞进行的插入位点分析一致 20 。特别是,在后期时间点没有证据表明一个或多个克隆型的优势。总的来说,这些发现表明持久性标记的功能收敛不是由克隆扩张驱动的。

评估T细胞上的持久性特征
由于作者观察到了跨患者和细胞内的数千个细胞中CAR-T细胞的转录收敛,作者推测持久性特征可能在不同的CAR-T细胞产品中普遍存在。迄今为止,只有一项关于持久性CAR-T细胞的单细胞转录组学研究已经报道,该研究涉及两名患有CLL的成年患者,他们接受了抗CD19 CAR-T细胞(CTL019细胞)治疗,这些细胞已经持续存在了十年 7 。作者通过为每个细胞分配一个持久性特征分数(在Seurat中使用AddModuleScore函数 21 ),对这两名患者的CAR-T细胞数据进行了分析。值得注意的是,CTL019持久存在的CD4 CAR-T细胞几乎完全表达了该模块的所有基因(17/22个基因)(图6a)。为了以无偏、定量的方式比较作者的CARPALL CAR-T细胞信号与CTL019细胞,作者使用了一种基于逻辑回归的细胞对细胞匹配方法 22 。作者发现,持久存在的CTL019 CD4 CAR-T细胞与CARPALL数据中持久存在的双阴性T细胞之间存在最强的匹配(图6b)。值得注意的是,持续存在的CTL019细胞主要来源于患者1(541/959,56%),尽管令人欣慰的是,持续存在的特征也在患者2的少数细胞中显现(40/959,4%)。总体而言,持续存在的CARPALL和CTL019 CAR-T细胞的相似性不仅限于基因集,而是扩展到整个转录组。
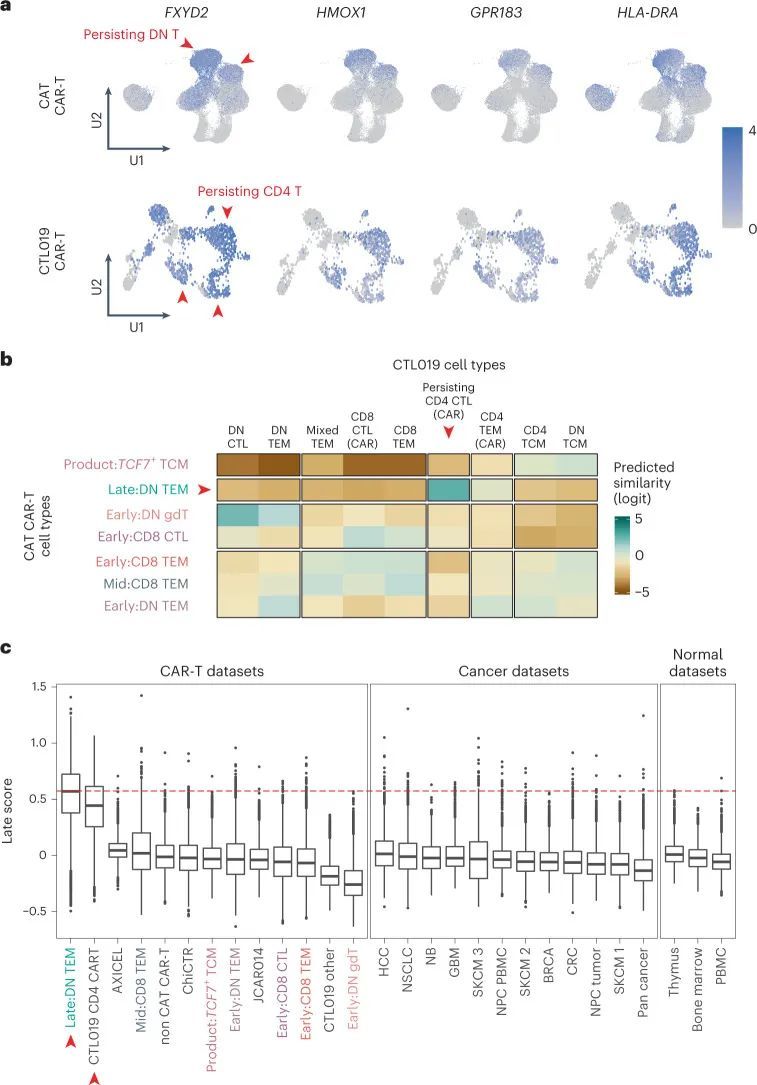
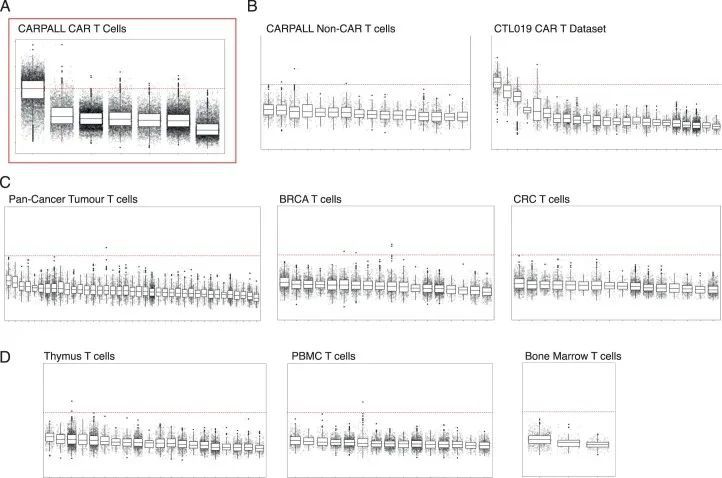
然后作者质疑CAR-T细胞的持久性特征是否有生理相关性。为此,作者对来自各种健康组织、其他迄今为止的CAR-T研究和癌细胞单细胞图谱的T细胞进行评分,包括正常外周血、人类胎儿骨髓、人类胎儿胸腺以及多达16种人类癌症,包括被认为具有免疫原性并对免疫检查点抑制剂有长期反应的肿瘤(例如肺癌和黑色素瘤)。作者无法在任何一个组织中以可观的频率检测到具有持久性特征的T细胞,除了偶尔的细胞(图6c和扩展数据图9)。各组织中的中位频率为-0.04(-0.6至1.4)。这些观察结果表明,CAR-T细胞的持久性特征在其他生物环境中很少发现。
总结
作者发现,迟发性的CAR-T细胞主要由一群在转录或表面表达上不表达CD8-α或CD4辅助受体的细胞组成。在健康个体中,双阴性细胞通常只占所有T细胞的一小部分,作者观察到在同一患者的非CAR T细胞中也存在类似的比例。总体而言,CD8 + CAR-T细胞的数量随时间的推移稳步减少,而双阴性细胞的比例逐渐增加。这与成人慢性淋巴细胞白血病(CLL)患者中长寿命的CAR-T细胞形成对比,那里早期时间点就观察到了双阴性CAR-T细胞群体,并经进一步研究确定为γδ T细胞。虽然作者的队列中也观察到了四名患者中的γδ T细胞,但它们并没有对其他患者的早期CAR-T细胞群体做出贡献。对这篇文章的思路感兴趣的老师,欢迎咨询!
本文来自互联网用户投稿,该文观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。 如若内容造成侵权/违法违规/事实不符,请联系我的编程经验分享网邮箱:chenni525@qq.com进行投诉反馈,一经查实,立即删除!