综合分析突变揭示了27种儿童癌症之间的不同模式和分子过程
今天给同学们分享一篇实验文章“Comprehensive analysis of mutational signatures reveals distinct patterns and molecular processes across 27 pediatric cancers”,这篇文章发表在Nat Cancer期刊上,影响因子为22.7。

结果解读:
27种儿童癌症的体细胞突变频率
从作者先前发表的研究中收集了785个全基因组测序的肿瘤-正常对的数据集(PedPanCan队列,PPC-WGS,https://www.kitz-heidelberg.de/en/research/datacommons/pedpancan)和圣裘德儿童癌症基因组项目(https://www.stjude.org/research/translational-innovation/pediatric-cancer-genome-project.html),总共涵盖了27种分子定义的儿童癌症实体(图1a)。使用共识变异检测流程,包括更新的德国癌症研究中心(DKFZ)内部突变检测流程和mutect2(参考文献1),鉴定了SBS和IDs,大大提高了鉴定到的体细胞变异的质量(扩展数据图1a)。在整个队列中,作者总共鉴定到了2,834,456个SBS和252,722个IDs。每百万碱基对的SBS突变数量(中位数0.2350;范围0.0007-625.5)和IDs(中位数0.0036;范围0.00036-41.43)在个体肿瘤和不同癌症类型之间变化很大(图1a和附表1)。毛细胞星形细胞瘤的总体体细胞突变负担最低(中位数0.每百万碱基对的总突变数为0.34)最低,DLBLNOS(弥漫性大B细胞淋巴瘤,未特指)最高,每百万碱基对的中位数为1.83)。虽然每个肿瘤的插入缺失突变负担较低,但SBS和ID的数量在肿瘤间存在显著相关性(Spearman r = 0.91; 图1b)。如先前在不同癌症类型中描述的那样,SBS和ID的突变负担在这个儿童队列中也与年龄明显相关(扩展数据图1b)。少数(n = 3)被分类为高级别胶质瘤(HGG,K27wt)且具有DNA错配修复基因(MSH6,PMS2)的胚系变异的肿瘤表现出高突变表型,每百万碱基对的中位数为79.23(图1b)。
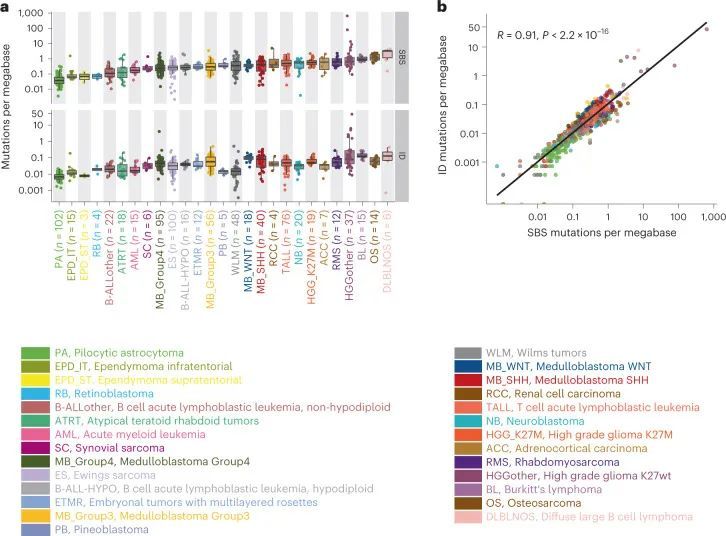
儿童癌症中的突变特征
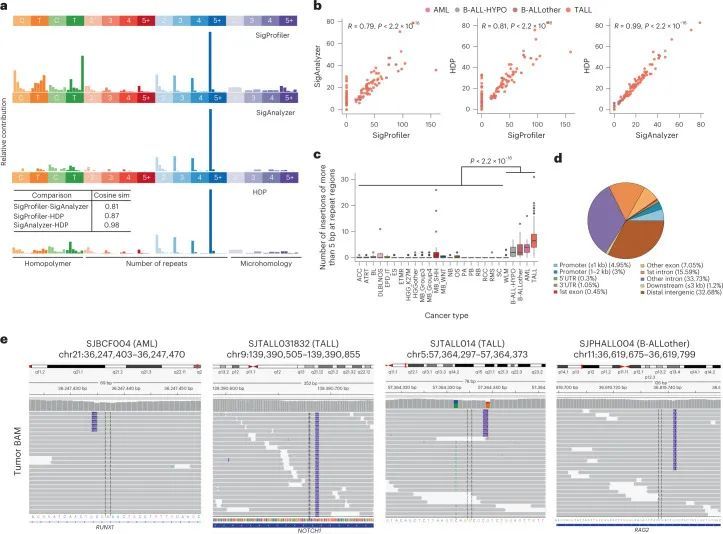
为了提取在这个儿童全癌症队列中活跃的突变特征,作者生成了96上下文的SBS和83上下文的ID突变目录(图2a),并使用了基于不同NMF原理的两种广泛使用的方法SigProfiler和SignatureAnalyzer(以下简称SigAnalyzer)。此外,还实施了第三种非NMF方法,称为分层狄利克雷过程(HDP),用于识别白血病的ID特征。由于每个儿童肿瘤中双碱基替代(DBS)的数量非常低,作者只从SBS和ID中提取特征。由于SigProfiler参考特征在科学界被广泛使用(COSMIC v.3),这里概述了SigProfiler的结果,SigAnalyzer的结果在附录表2、3、4和5中呈现。
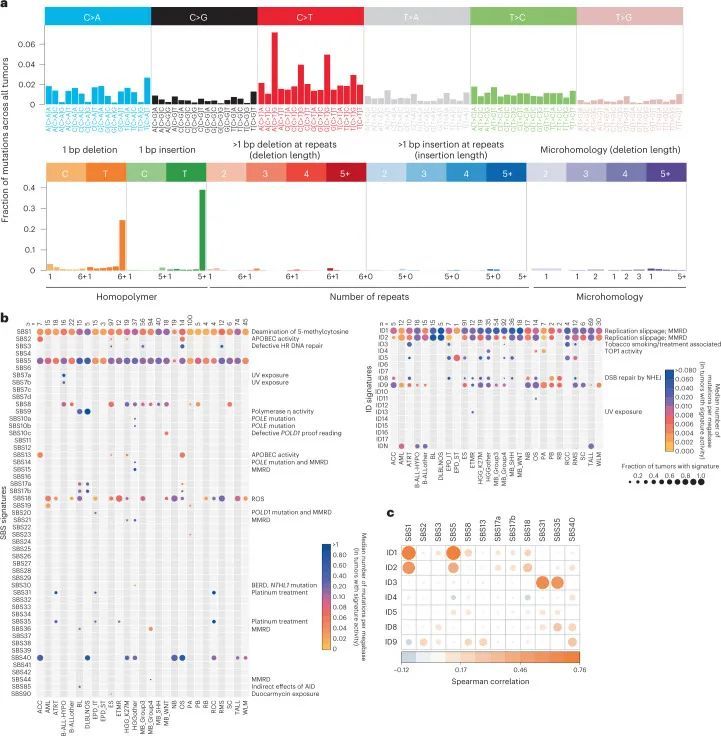
SBS特征
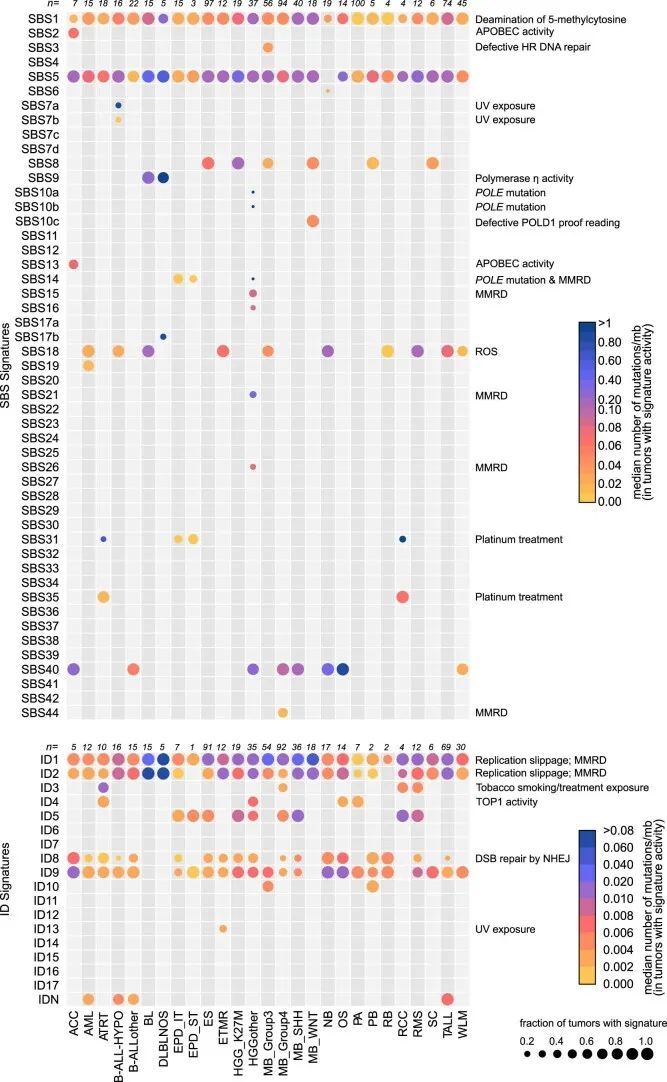
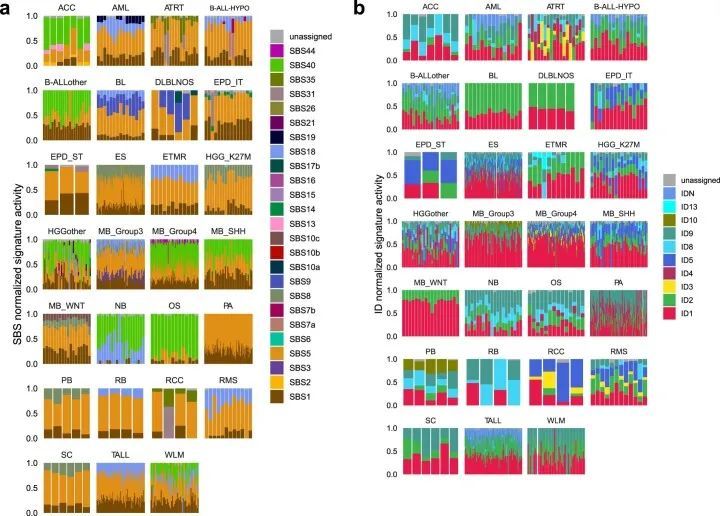
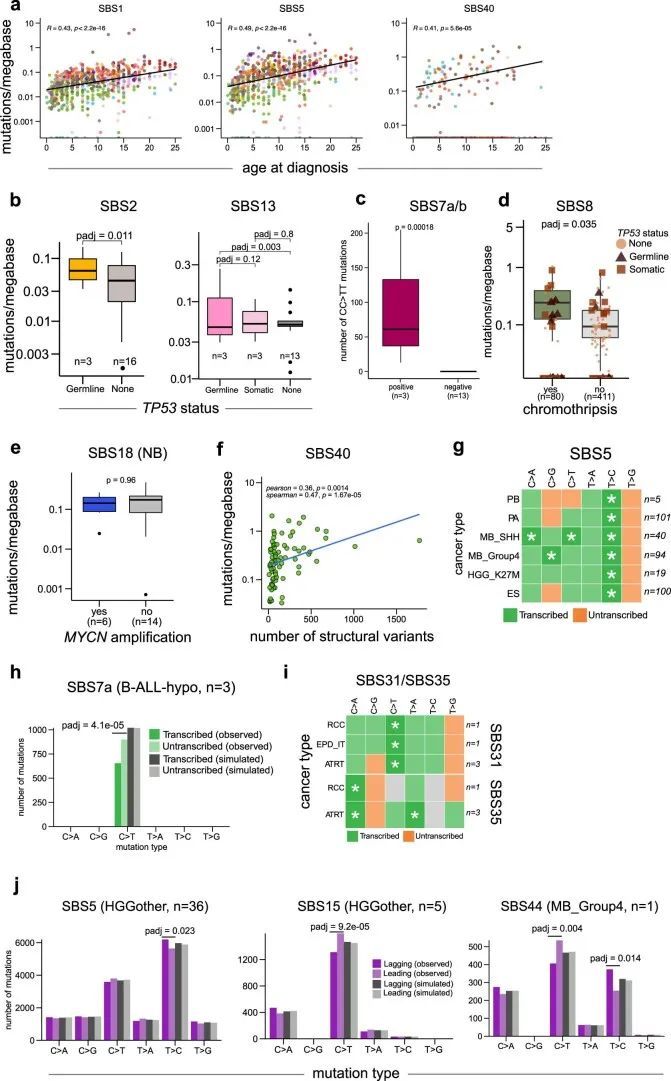
总共提取了29个与COSMIC v.3 SBS签名匹配且至少在该队列的一个肿瘤类型中存在的SBS签名(图2b,补充表6和扩展数据图2;方法)。SigProfiler识别的突变签名对每个实体的肿瘤都产生了影响,并且在SigAnalyzer中也得到了一致的识别(扩展数据图3、4和5)。其中,SBS1和SBS5分别在该队列的98.2%和96.6%的样本中存在(图2b和补充表6、7)。正如在成人癌症和小部分儿童脑肿瘤中所描述的那样,SBS1和SBS5的钟表特性也在该队列中观察到,与诊断年龄的签名活性呈显著相关(扩展数据图6a)。另外,还发现了一种未知病因的签名,即SBS40,在九种儿童癌症类型和该队列的11.7%肿瘤中活跃(图2b和补充表7),并且与诊断年龄也存在相关性(扩展数据图。6a),6a),暗示了一个额外的类似时钟的特征。

ID特征
作者的队列中共鉴定出十个ID特征,其中九个与COSMIC v.3特征交集,作者在这里鉴定出的一个特征称为IDN(图2b和附表10)。与SBS特征类似,SigProfiler的新建特征提取中最常见的ID特征也一致地被SigAnalyzer鉴定出来(扩展数据图3、4和5)。正如在PCAWG突变特征分析中观察到的那样,ID1、ID2、ID5、ID8和ID9在多种癌症类型的肿瘤中都是活跃的(图2b、扩展数据图3和附表10)。ID1和ID2是由复制滑动引起的DNA损伤,分别在本队列的约92.2%和约67.2%的肿瘤中存在(附表11;本队列中最常见的ID特征)。虽然ID5和ID9在多种癌症类型中存在,但这些特征导致的突变在相对较小比例的肿瘤中出现(附表11)。ID8,是由DNA双链断裂(DSB)的非同源末端连接(NHEJ)修复引起的潜在损伤所导致的一种特征,在整个队列中占4.8%(n = 38)。作为PCAWG的一部分,对肿瘤的大规模队列分析显示,ID8活性与诊断时的年龄相关,表明该特征具有类似时钟的行为。然而,在作者的队列中,作者没有观察到这样的相关性,可能表明儿科组织中ID8突变的速率不同。
接下来,作者试图确定插入缺失(indel)特征活性与年龄、TP53基因突变状态、染色体断裂和基因组不稳定性之间的潜在关联。在作者的队列中,作者观察到ID1、ID2和ID9特征活性与诊断年龄高度相关(扩展数据图7a),揭示了它们在儿童癌症中的类似钟表行为,就像在成年人中观察到的那样。虽然ID4特征活性仅存在于三种癌症类型和一小部分肿瘤中(队列的3.2%,n = 25个肿瘤,附表10和11),但已观察到ID4活性与诊断年龄之间存在显著相关性(扩展数据图7a)。最近的一项研究表明,ID4的突变模式可能是由于拓扑异构酶1的活性,并且这种模式可能存在于体细胞癌细胞和生殖细胞中。整体结构变异的数量与队列中ID9特征活性高度相关(扩展数据图7b),这表明基因组不稳定性相关机制对ID9突变的贡献。此外,在作者的队列中,作者还观察到一小部分肿瘤中存在罕见的成年肿瘤标记(即ID3、ID10、ID11和ID13)(附表10和附表11)。然而,作者没有发现这些肿瘤之间存在任何常见的基因组改变。由于作者队列中插入缺失的数量非常低,作者无法对已确定的标记进行系统的链不对称性分析。然而,与最近一项基于成年癌症的研究结果类似,作者观察到与不同标记相关的突变在基因间区域富集(扩展数据图7c)。值得注意的是,评估分配给每个ID标记的插入缺失的可映射性显示,大部分插入缺失来自唯一映射的基因组区域(扩展数据图7d)。
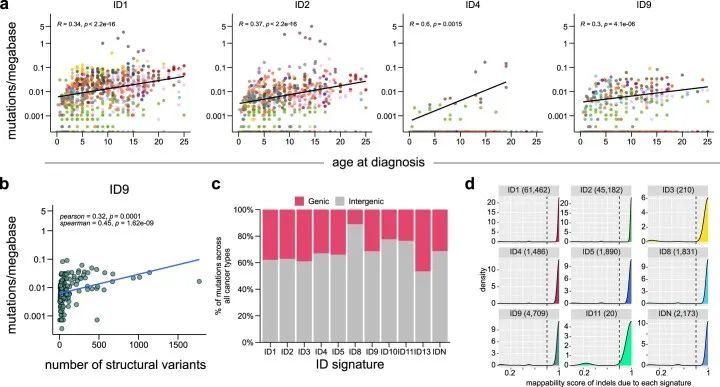
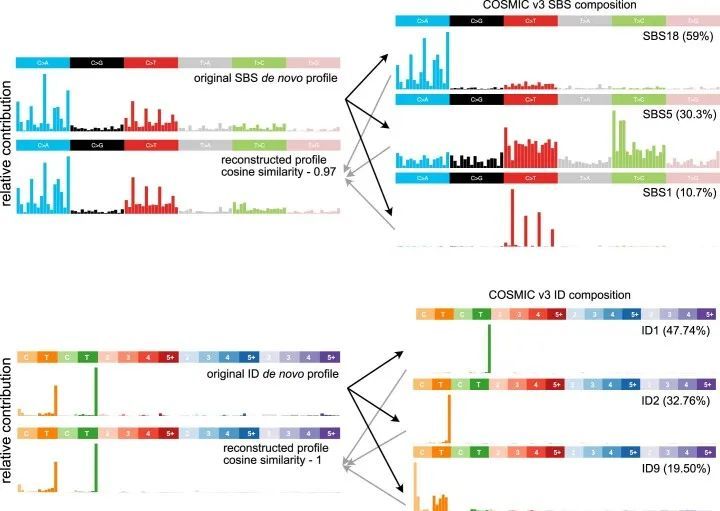
IDN的特征在COSMIC v.3中尚未报道。这个签名已经通过三种独立的方法一致地被识别出来,具有高度相似性(图3a和附表12)。这个不可磨灭的签名的特点是在非重复区域插入超过1个碱基对(bp)的插入,通常插入长度超过5个bp(图3a)。通过三种不同的新生签名提取方法,归因于这个签名的突变数量也高度相关(图3b)。接下来,作者比较了不同癌症类型中签名特征突变的总数,并发现在B-ALL、AML和T-ALL中有显著富集(图3c),其中T-ALL中IDN签名的比例最高,但并未特异性地富集于任何T-ALL亚型或任何潜在的体细胞突变。对这些突变的基因组分布的分析表明,这些插入的大部分存在于内含子和远离基因间区域,但也存在于编码外显子中,包括已知的癌症基因,如NOTCH1(图3d,e)和PHF6。为了确保归因于IDN特征的突变不是由于变异调用工具的人为因素,作者在整合基因组浏览器(IGV)中对单个突变进行了目视检查,并确认它们的高质量,例如,当相邻的杂合单核苷酸多态性(SNP)在靠近时,这些突变仅出现在一个等位基因上,由相同的读取跨越(图3e;SJTALL014)。接下来,作者对这些肿瘤中IDN活性与诊断年龄以及其他SBS特征进行了相关性分析。尽管作者没有发现与年龄的显著相关性(Spearman r = 0.26,虚假发现率(FDR)= 0.072;Pearson r = 0.22,FDR = 0.052),但作者观察到与SBS1(Spearman r = 0.77,FDR = 3.7 × 10 –11 ;Pearson r = 0.56,FDR = 1.9 × 10 –8 )和SBS40(Spearman r = 0.79,FDR = 0.009;Pearson r = 0.38,FDR = 0.0005)之间存在强相关性(附表13)。
HR修复途径是一种无误差的机制,用于修复DNA双链断裂(DSBs)。HR途径的组分基因组变异,主要是BRCA1/2,导致了微同源(MH)区域的特征性SBSs和更大的缺失,这种表型也被称为BRCAness。以往主要关注乳腺和卵巢癌的研究已经确定了BRCA1/2双等位基因致病突变与signature.3(COSMIC v.2)活性之间的强相关性。然而,这些肿瘤中有相当一部分显示了signature.3活性,但在HR途径组分中没有发现任何可识别的变化。鉴别肿瘤中HR缺陷COSMIC v.3签名SBS3和ID6的活性是重要的,因为先前的研究已经表明它与铂类和聚合酶(PARP)抑制剂治疗的治疗反应有关。
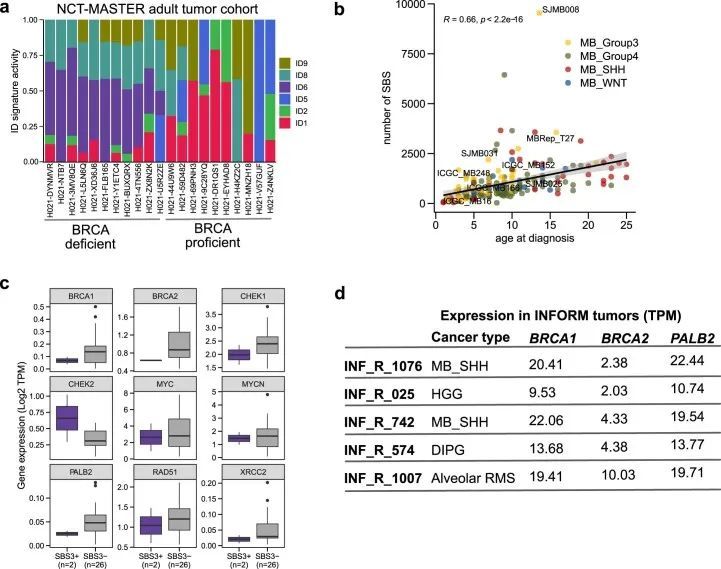
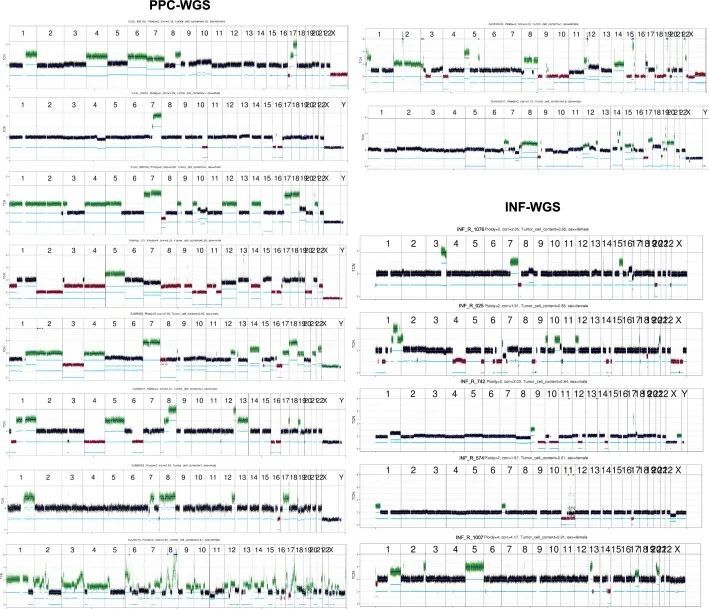
以前对儿童肿瘤的突变特征的分析,包括作者自己的已发表分析,已经确定了一个相当大的比例(整个队列的54%)的Signature.3(COSMIC v.2),主要出现在没有任何HR通路基因缺陷的肿瘤中。然而,使用COSMIC v.3特征的当前分析只发现了一小部分(整个队列的2.29%)具有SBS3特征活性的肿瘤(图4a,b)。这种显著差异很可能是之前的Signature.3突变被归因于更新和精确化的COSMIC v.3突变特征中的“平坦”特征(例如SBS5和SBS40)。此外,与初始特征分析相比,作者的方法也有所不同,作者将SBS1和SBS5作为背景特征,并仅在余弦相似度至少提高0.02时才添加SBS3。然而,这些具有SBS3的肿瘤中没有一个显示出相关的ID6特征活性,即在MH区域具有大量长的缺失(图4b)。这种ID6的缺乏促使作者测试作者当前的变异调用流程是否会通过分配低置信度来惩罚微同源的缺失,或者儿童癌症是否普遍具有非常低的MH相关缺失数量作为固有特性。为了进一步测试这一点,作者对INFORM注册表(https://www.dkfz.de/en/inform/index.html;INF-WGS样本集)中的五个肿瘤进行了全基因组测序,这些肿瘤已知(可能)具有基于ClinVar的BRCA1/2致病性生殖系突变。其中,INF_R_1076具有BRCA2致病性纯合突变,INF_R_025具有BRCA2复合杂合突变(这两个患者还具有明确的表型,即Fanconi贫血),而其余肿瘤具有杂合(可能)致病性BRCA1/2突变(图4c),肿瘤中没有第二次打击。对这五个儿童肿瘤的突变签名分析显示,只有具有致病性纯合BRCA2突变的肿瘤,即两等位基因失活,显示了SBS3和ID6签名活性(图4c和附表14)。此外,作者对NCT_MASTER精准肿瘤学计划(https://www.nct-heidelberg.de/master)中的22个全基因组测序的成年肿瘤进行了分析,针对ID特征进行了分析,其中的体细胞突变是使用相同的DKFZ内部流程进行调用的。在这些肿瘤中,一半(n = 11)已知存在BRCA1/2缺陷,并显示出明显的ID6活性(扩展数据图图8a和附表15),这是预期的。这些结果表明作者的变异调用流程不会系统性地漏掉MH区域的缺失,并确认了双等位基因BRCA1/2失活对于预测HR缺陷相关突变特征(即SBS3和ID6)的存在的重要性。
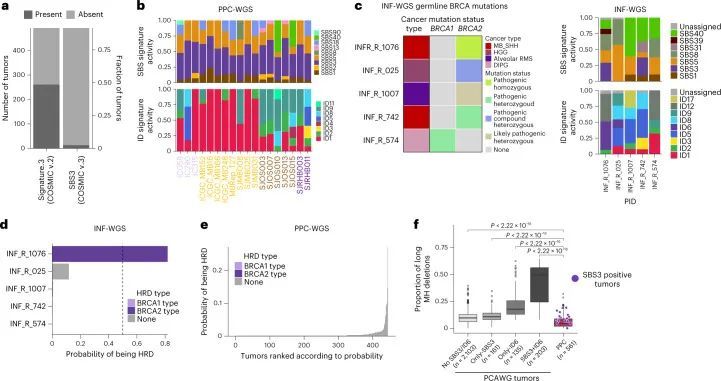
接下来,作者利用同源重组缺陷分类器(CHORD) 48 ,基于随机森林的分类器,根据肿瘤的体细胞突变目录和基因组不稳定性信息将肿瘤分类为BRCA1或BRCA2 HR修复缺陷(HRD)表型。作者系统地将CHORD应用于PPC-WGS和n = 5 INF-WGS肿瘤。在INFORM肿瘤中,只有一个具有BRCA2致病性纯合突变(INF_R_1076)的肿瘤被确定为BRCA2 HRD表型,概率很高(0.82)(图(图4d))。该肿瘤还显示了来自突变签名分析的SBS3和ID6的活性以及BRCA2基因的低表达(扩展数据图(图8d))。来自INFORM或PPC-WGS的其余肿瘤(图4d,e)显示出非常低的可能性,即它们既不属于BRCA1也不属于BRCA2 HRD表型,这表明BRCA1/2双等位基因突变的失活和SBS3与ID6突变签名活性的组合可能是所谓的BRCAness表型的潜在生物标志物。
接下来,作者试图了解儿童肿瘤中是否存在微同源序列(MH)的长缺失(>5 bp)的比例,尽管比例非常低。为了了解MH相关缺失在ID6阳性成人肿瘤中的表现,作者将PCAWG全基因组肿瘤(n = 2,602)分为不同的类别,取决于SBS3和ID6的存在与否。然后,作者将这些类别中的肿瘤的MH相关缺失比例(作为所有缺失的一部分)与作者的儿童癌症队列进行比较。这项分析显示,与成人肿瘤相比,儿童肿瘤整体上几乎没有MH相关缺失,并且与ID6阳性肿瘤相比,比例显著较低(图4f)。
在作者的队列中,具有SBS3特征活性的肿瘤中,44%(18个中的8个)属于髓母细胞瘤(MB)的Group3亚组。众所周知,MB随着年龄的增长呈线性增加的体细胞突变负担。可以推测,不遵循这种相关性的肿瘤中的突变可能是由于除了普遍的类似时钟的特征之外的突变过程所贡献的。在这个分析中,作者只发现了一个肿瘤(SJMB008),其活跃的SBS3特征作为年龄与突变负担相关性的异常值,这表明大多数其他SBS3阳性的Group3 MBs随着年龄的增长而呈典型的线性增加突变负担的趋势(扩展数据图8b),因此,不能排除将类似时钟的特征(尤其是SBS5和SBS40)的突变错误地归属于SBS3的可能性。接下来,作者比较了SBS3阳性和阴性肿瘤中的HR通路基因(如BRCA1/2和PALB2)的表达,在Group3 MBs中可能存在其他机制来失活这些基因的表达。作者观察到SBS3阳性和阴性肿瘤之间这些基因的表达方面没有任何差异(扩展数据图8c)。此外,这些SBS3阳性肿瘤的基因组相对稳定,异常值很少(扩展数据图9)。
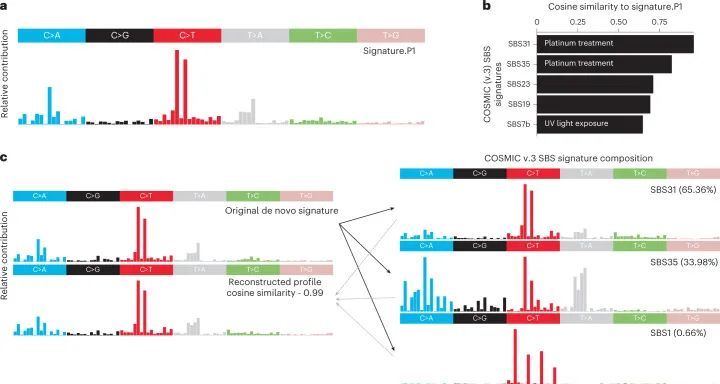
P1与COSMIC v.3的相似性
根据COSMIC v.2参考签名对这个队列的一个子集进行的先前突变签名分析发现了一个新的替代签名,称为P1签名,其特点是在CCC/CCT 2 的背景下C>T突变升高(图(图5a))。P1签名在小儿脑肿瘤非典型畸胎/横纹肌瘤瘤(ATRT)和脑室管膜瘤中活跃。在当前分析中,将P1签名与所有已鉴定的COSMIC v.3 SBS签名进行了比较,发现与SBS31和SBS35存在高度相似性(图(图5b)),这两者都是铂类治疗引起的DNA损伤的结果。在将新生签名分解为COSMIC v.3签名的分析中,发现SBS31和SBS35以混合形式存在于P1签名中(图(图5c))。这种铂类治疗签名活性在ATRT、脑室管膜瘤、多层玫瑰胚胎瘤(ETMR)和小儿肾细胞癌(RCC)中被发现(图(图2b2b)和附表6)。此外,Lambo等人。研究表明,大多数复发ETMR中获得的突变是由顺铂治疗引起的,类似于P1特征。因为经过治疗后,单核苷酸变异的组成发生了改变,但在随后的ETMR复发中保持相似。
总结
总之,尽管这个队列中有一些罕见的癌症实体被低估了,但作者相信对27种儿童癌症的突变签名库进行的这项分析为进一步理解肿瘤生物学提供了宝贵的资源,并有助于未来研究中定义治疗反应的生物标志物。
本文来自互联网用户投稿,该文观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。 如若内容造成侵权/违法违规/事实不符,请联系我的编程经验分享网邮箱:chenni525@qq.com进行投诉反馈,一经查实,立即删除!