7+非肿瘤+线粒体+PPI+机器学习+实验,多套路搭配干湿结合
今天给同学们分享一篇生信文章“Identification of mitochondrial related signature associated with immune microenvironment in Alzheimer's disease”,这篇文章发表在J Transl Med期刊上,影响因子为7.4。

结果解读:
在ND和AD样本中鉴定差异表达基因
该研究的流程图如图1所示。PCA分析显示了AD和ND样本的分布。所选数据集的详细信息如表3所示。在GSE122063中经过预处理筛选出了18378个基因,并通过adj.p.val和Log2FC鉴定出了2832个差异表达基因(DEGs),其中包括1119个上调基因和1713个下调基因(图2a)。在GSE132903中筛选出了493个DEGs,其中包括207个上调基因和286个下调基因(图2b)。分别使用热图表示了GSE122063和GSE132903数据集中前25个上调基因和前25个下调基因(图2c,d)。结果显示根据差异基因可以区分出两组。
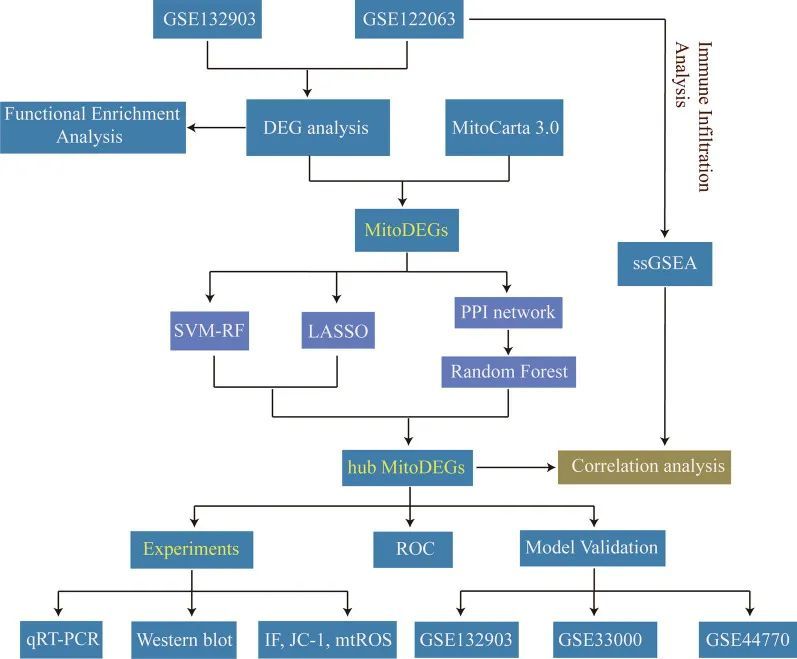
潜在功能和差异表达基因的途径
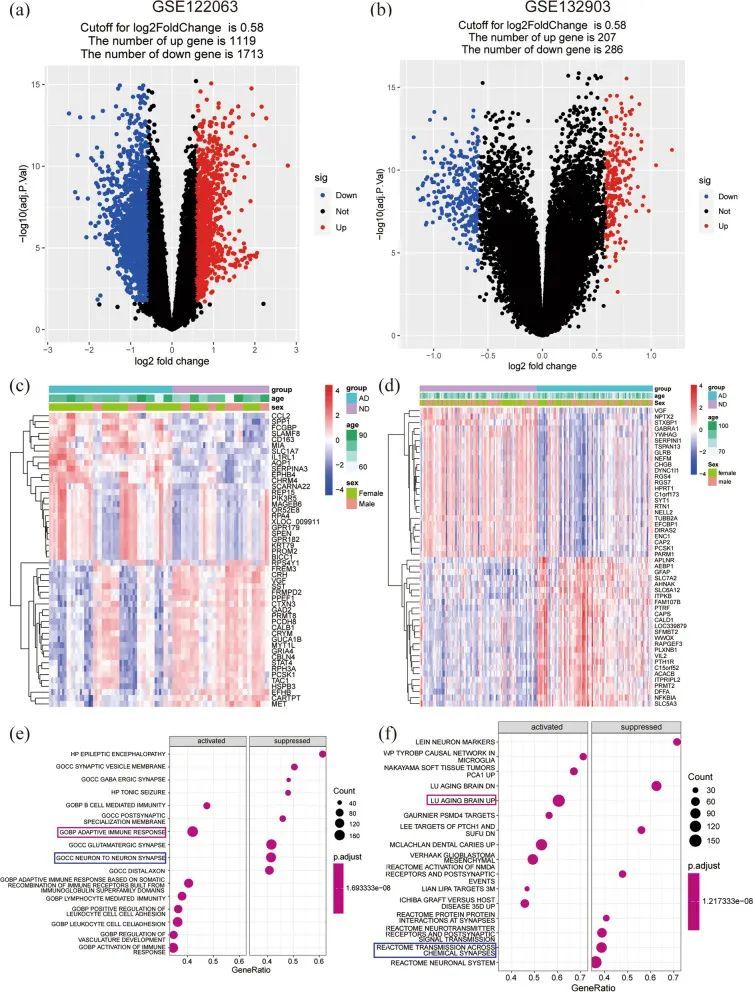
将前八个显著激活的基因集和前八个抑制的基因集以点图的形式呈现,这些基因集来自于MSigDB的C5基因集。发现免疫反应显著激活,神经元间突触受到抑制(图2e)。同样,将MSigDB的C2基因集中前八个显著激活的基因集和前八个抑制的基因集以点图的形式展示。与脑衰老相关的基因被显著激活,与化学突触传递相关的基因被抑制(图2f)。
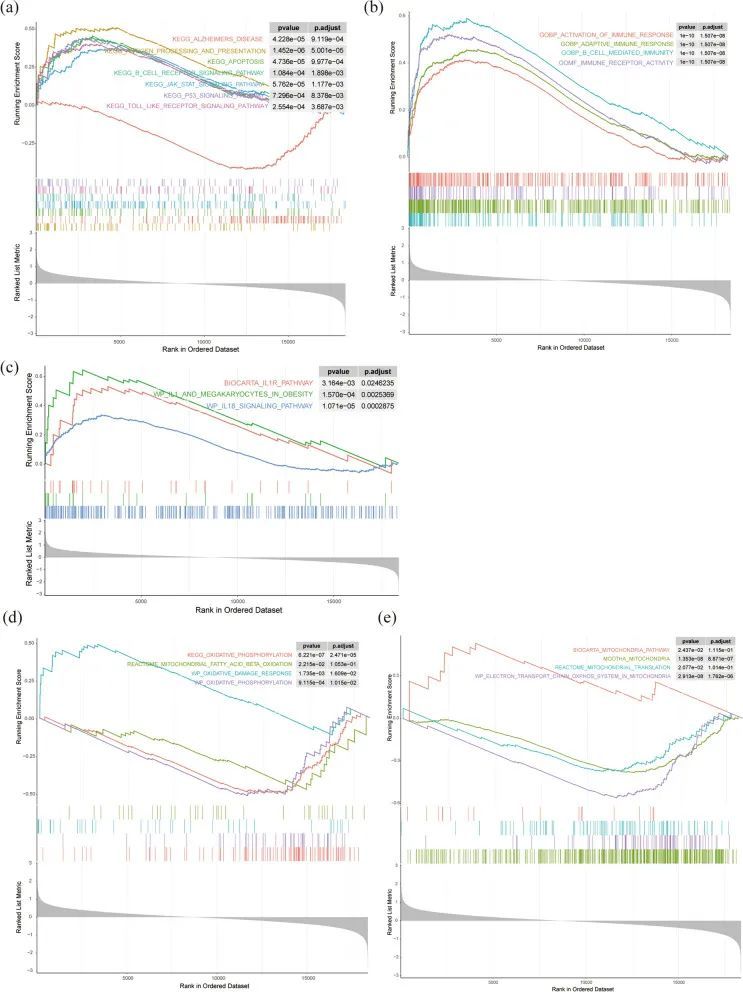
GSEA结果显示,抗原处理和呈递、凋亡、B细胞受体信号通路、JAK-STAT信号通路、p53信号通路、类似受体(TLRs)信号通路在KEGG术语中富集(图3a)。此外,还显示差异表达基因主要参与免疫应答激活、IL1R通路、IL18信号通路以及氧化磷酸化(OXPHOS)、线粒体脂肪酸β氧化、氧化损伤应答、线粒体通路、线粒体翻译、线粒体中的电子传递链-OXPHOS系统(图3b-e)。这些结果表明炎症反应和线粒体代谢在AD病理中起重要作用。
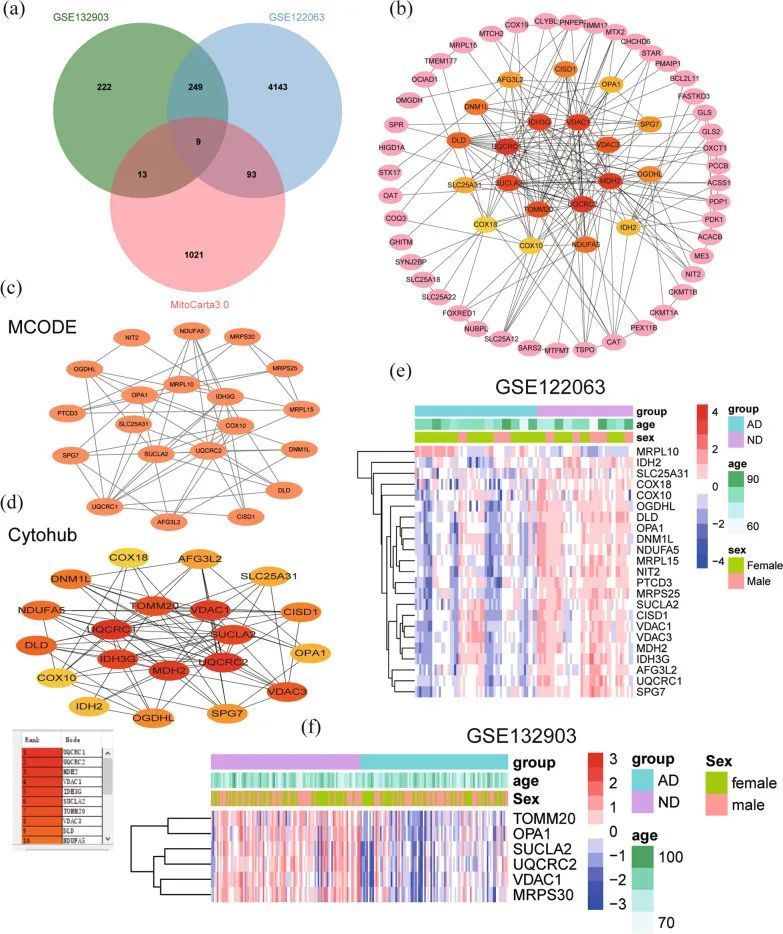
蛋白质相互作用网络分析和筛选中心MitoDEGs
从MitoCarta3.0数据库中获取了与线粒体相关的基因,并将这些基因与从GSE122063和GSE132903数据集中筛选出的DEGs进行交集,结果得到了115个交集的MitoDEGs(图4a)。115个MitoDEGs的表达水平在附加文件4:文件S2中显示。使用STRING数据库对115个MitoDEGs进行PPI分析,并使用Cytoscape进行网络可视化(图4b)。使用Cytoscape的插件MCODE识别出重要模块,并选择了一个包含20个节点和53条边的模块(图4c)。同时,使用插件CytoHubba从PPI网络中识别出前20个关键基因(图4d)。在组合后共获得了26个基因,其中包括GSE122063中的23个基因和GSE132903中的6个基因(图4e,f)。
关键基因的筛选和与免疫细胞的相关性分析
为了筛选关键基因,作者将从PPI分析中获得的23个DEGs做随机森林分析。具有显著值大于3的前六个基因被确定为进一步分析的候选基因(图5a,b)。MRPL10在AD组中表达显著增高,而SPG7、MRPS25、NIT2、OPA1和DLD在AD组中表达较低(图5c,d),如热图所示。在这六个MitoDEGs中,发现SPG7、MRPS25、NIT2、OPA1和DLD与记忆B细胞、效应记忆CD8 T细胞、活化树突状细胞、自然杀伤T细胞、17型T辅助细胞、MDSC、中性粒细胞、浆细胞样树突状细胞呈负相关。MRPL10与这些免疫细胞呈正相关(图5e)。
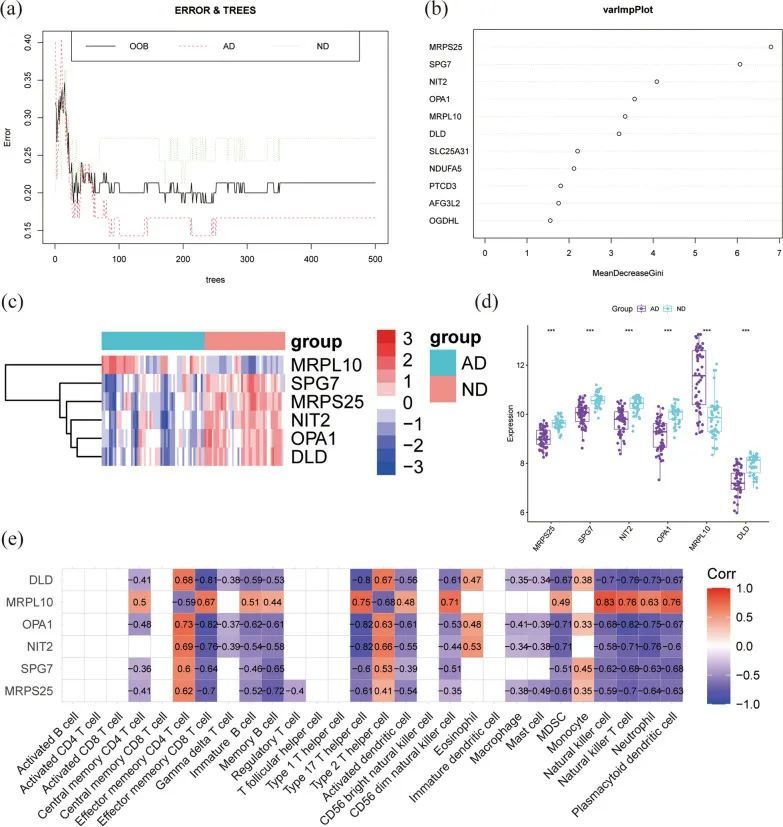
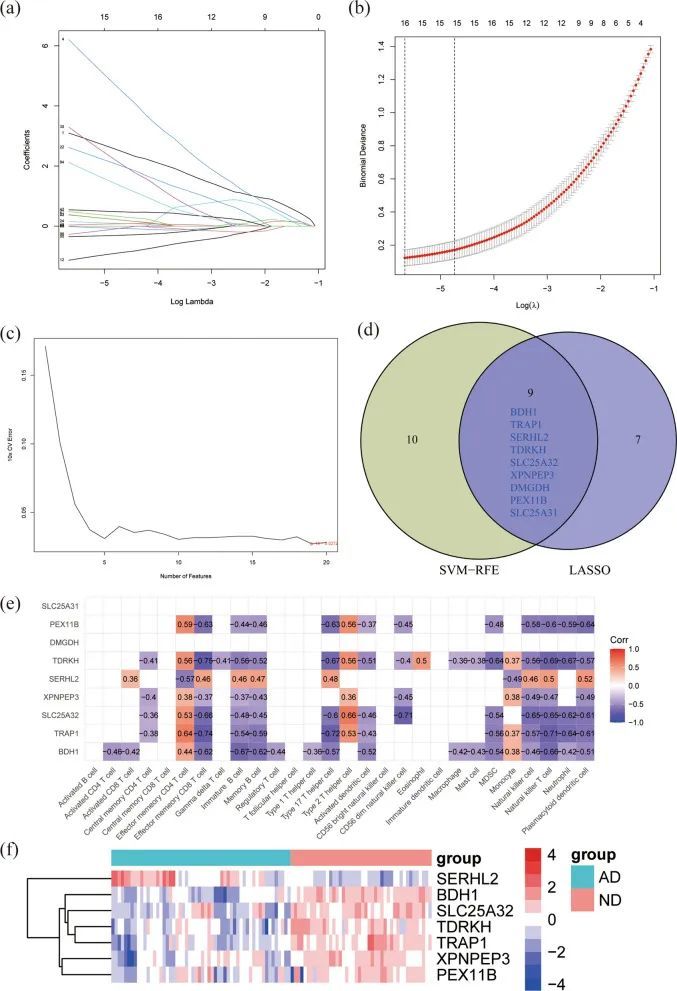
为了进一步提高AD的关键MitoDEGs的质量,作者使用了两种不同的机器学习算法来筛选基因。作者使用LASSO方法找到了16个特征MitoDEGs(图6a,b),并使用SVM-RFE算法获得了19个特征基因(图6c)。使用两种机器学习算法获得的基因的交集用于鉴定后续研究中的9个mitoDEGs(图6d)。为了进一步探索9个MitoDEGs与免疫细胞之间的潜在关系,作者发现SLC25A31和DMGDH与免疫细胞亚群之间没有关联(图6e,通过Spearman方法)。因此,这两个基因被排除在进一步的研究之外。AD和ND样本中七个MitoDEGs(BDH1,TRAP1,SERHL2,TDRKH,SLC25A32,XPNPEP3,PEX11B)的表达水平如图所示(图6f)。这些结果表明这七个基因与记忆B细胞、效应记忆CD8 T细胞、活化树突状细胞、自然杀伤T细胞、17型T辅助细胞、MDSC、中性粒细胞、浆细胞样树突状细胞有关。
AD中的免疫细胞浸润
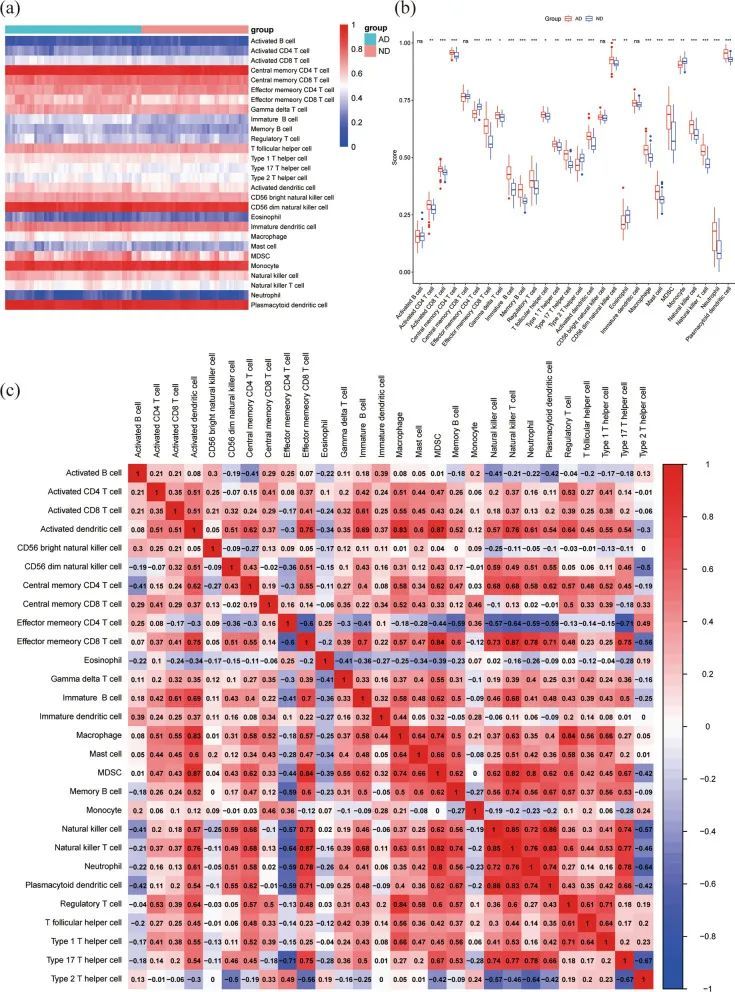
在AD组和ND组中分析了28个免疫细胞浸润,并发现AD组和ND组之间有24种免疫细胞亚群存在差异(图7a,b)。其中,AD组中巨噬细胞、活化的CD8 T细胞、活化的CD4 T细胞、效应记忆CD8 T细胞、记忆B细胞、自然杀伤细胞、自然杀伤T细胞、17型T辅助细胞、中性粒细胞、髓系抑制细胞、浆细胞样树突状细胞、调节性T细胞、活化的树突状细胞的比例增加。而效应记忆CD4 T细胞、2型T辅助细胞、单核细胞、嗜酸性粒细胞的比例减少。此外,进一步分析免疫细胞的浸润表明细胞之间存在复杂的相关性(图7c),例如效应记忆CD8 T细胞/自然杀伤T细胞(0.87)、活化的树突状细胞/髓系抑制细胞(0.87)、自然杀伤细胞/自然杀伤T细胞(0.85)、浆细胞样树突状细胞/自然杀伤细胞(0.86)、巨噬细胞/调节性T细胞(0.84)、活化的树突状细胞/巨噬细胞(0.83)。
诊断模型
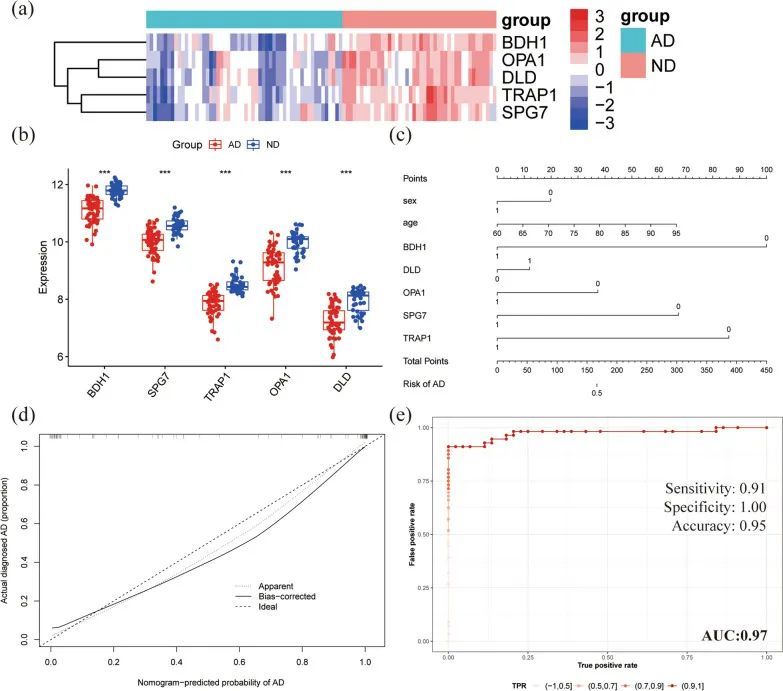
通过发现上述关键基因的生物功能,最终筛选出了五个线粒体差异表达基因(BDH1、TRAP1、OPA1、DLD和SPG7)。AD和ND样本中这五个线粒体差异表达基因的表达水平如图8a、b所示。通过结合这五个关键基因和临床特征(性别、年龄),建立了预测AD进展风险的标度图。每个基因和临床特征对应一个评分标准(图8c)。标度图的校准曲线证实了作者模型的良好预测性能(图8d)。此外,还进行了ROC曲线分析以评估标度图的预测能力。该模型的总体AUC为0.974,表明关键基因具有很高的诊断价值(图8e)。
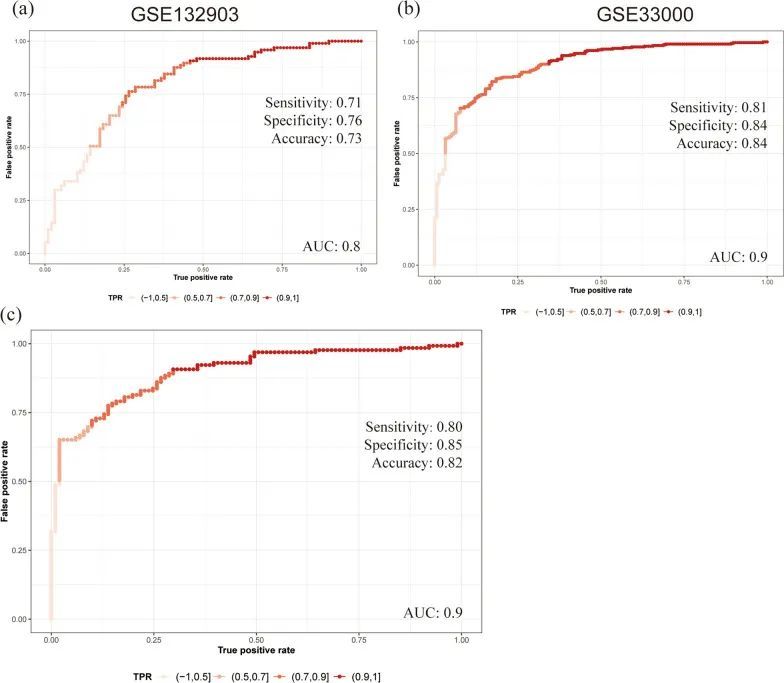
最后,作者使用三个独立的数据集来验证模型的准确性。使用逻辑回归算法计算了中心MitoDEGs的AUC值。在GSE132903数据集中的AUC为0.796,在GSE33000数据集中的AUC为0.898,在GSE44770数据集中的AUC为0.897,这表明该模型对AD的诊断是稳定的(图9a-c)。总之,作者利用这五个中心MitoDEGs开发了一个AD诊断模型。
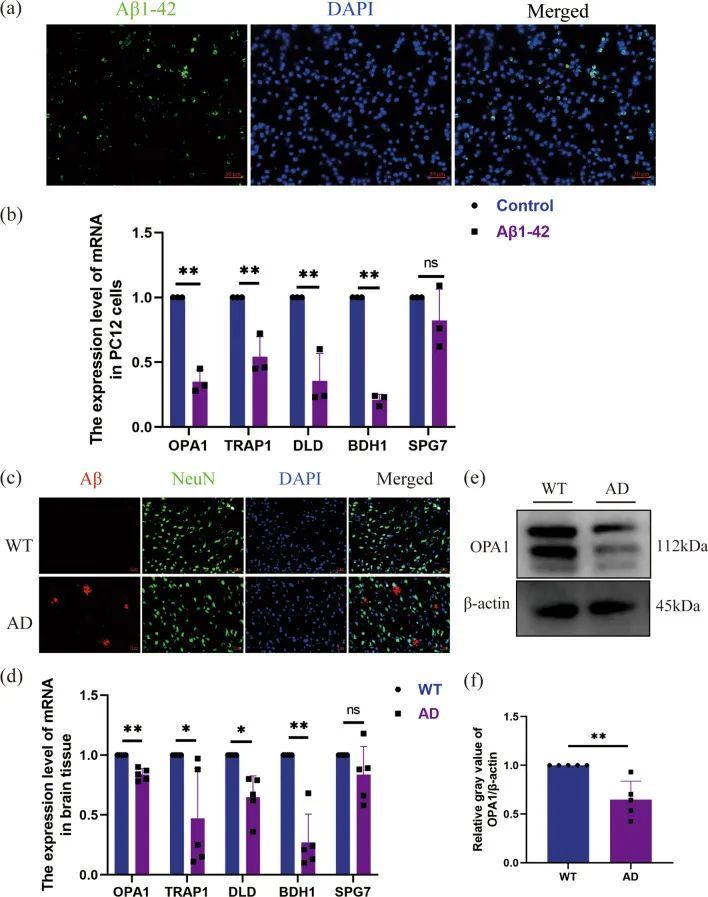
在PC12细胞和AD小鼠的脑组织中表达的hub MitoDEGs
为了确定Aβ1-42是否进入了神经元,对Aβ1-42处理12小时的PC12细胞进行免疫荧光染色显示神经元中存在Aβ1-42(图10a)。通过qRT-PCR检测PC12神经元中五个关键的线粒体差异表达基因(MitoDEGs)的mRNA表达情况。与对照组相比,Aβ1-42组中BDH1、TRAP1、OPA1、DLD的mRNA表达显著下降,而SPG7的表达在两组之间没有显著差异(图10b)。同样,对AD小鼠皮层中Aβ蛋白表达进行免疫荧光染色显示Aβ蛋白在AD小鼠中高度表达(图10c)。AD小鼠皮层中BDH1、TRAP1、OPA1、DLD的mRNA水平也显著下降,而SPG7的表达水平呈下降趋势(图10d)。OPA1蛋白水平在AD小鼠皮层中也显著下降(图10e, f)。这些结果表明,五个关键的线粒体差异表达基因的表达水平与生物信息学结果一致。
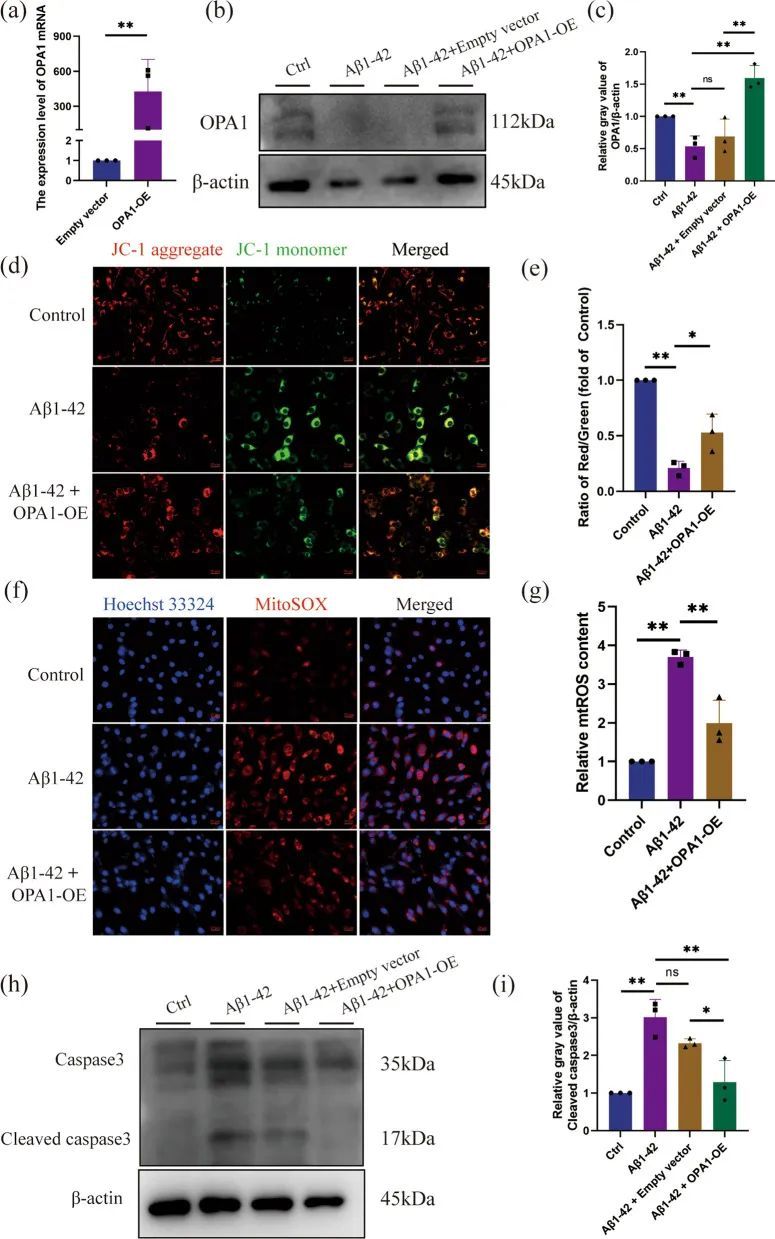
OPA1过表达减轻了Aβ1-42引起的线粒体损伤和神经元凋亡
OPA1已被确定为脂肪组织[48]、缺血性中风[49]、朊病[50]等研究的有前途的基因,并且其过表达已被证明可以改善线粒体功能障碍[50]。因此,作者选择研究OPA1进行验证。作者证明了在Aβ1-42处理的PC12细胞中,OPA1蛋白显著减少。过表达OPA1的质粒被转染到神经元中,转染效率明显(图11a-c)。OPA1的过表达减轻了Aβ1-42诱导的?Ψm丧失(图11d,e)。一致地,OPA1的过表达抑制了Aβ1-42诱导的PC12细胞线粒体ROS产生(图11f,g)。Aβ1-42诱导的PC12细胞中,剪切的caspase 3水平显著增加,而OPA1过表达后剪切的caspase 3水平显著降低(图11h,i)。综上所述,这些结果揭示了OPA1在维持线粒体稳定性和神经元凋亡中的关键作用。
总结
作者通过全面的生物信息学分析确定了AD和ND之间的DEGs,并进一步研究了与AD相关的线粒体基因,并阐明了中心线粒体DEGs与免疫细胞、免疫微环境和AD病理之间的紧密关系。筛选并验证了五个中心线粒体DEGs(BDH1、TRAP1、OPA1、DLD和SPG7),它们的mRAN表达水平在AD中降低,尽管SPG7的表达水平没有显著差异。最重要的是,BDH1、TRAP1、OPA1、DLD和SPG7与多种免疫细胞呈负相关,表明这些中心线粒体DEGs是AD中免疫和代谢的共调控分子。作者通过体内和体外实验证实了五个中心线粒体DEGs的表达水平,并发现OPA1过表达可以减少线粒体损伤和神经元凋亡。总的来说,这些发现有助于更好地理解AD的病因,并为探索潜在的诊断标志物和治疗策略提供了新的视角。
本文来自互联网用户投稿,该文观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。 如若内容造成侵权/违法违规/事实不符,请联系我的编程经验分享网邮箱:chenni525@qq.com进行投诉反馈,一经查实,立即删除!
- Python教程
- 深入理解 MySQL 中的 HAVING 关键字和聚合函数
- Qt之QChar编码(1)
- MyBatis入门基础篇
- 用Python脚本实现FFmpeg批量转换
- 【linux驱动】详细剖析第一个hello word驱动程序
- leetcode做题笔记2454. 下一个更大元素 IV
- 当执行 import vue from ‘vue’ 时发生了什么?
- 评估LLM在细胞数据上的实用性(1)-基本概述
- go 语言程序设计—第2章—程序结构
- Android 横竖屏切换之窗体泄露leaked window DecorView XXXActivity
- 会体言一心文-码代-4202
- Win7/Win10/Win11系统优点缺点
- Hash-based Message Authentication Code(HMAC)
- java SpringCloud版本b2b2c鸿鹄云商平台全套解决方案