肺癌相关文献6
第十四篇
Classification of lung adenocarcinoma based on stemness scores in bulk and single cell transcriptomes
IF:6.0 中科院分区:2区 生物学WOS分区:Q1被引次数: 4
背景:癌细胞具有无限期自我更新和增殖的能力[2]。在一部分癌细胞中获得干细胞样特征可促进细胞的持续增殖和去分化。此外,消除非干细胞但不消除干细胞可赋予癌症抗性和复发性。干细胞样和非干细胞样癌细胞的混合赋予肿瘤内异质性 (ITH)。此外,对免疫消除的抵抗已被证明是干细胞样癌细胞的一种特性[3]。
结果
1.bulk-肿瘤中LUAD干性亚型的鉴定
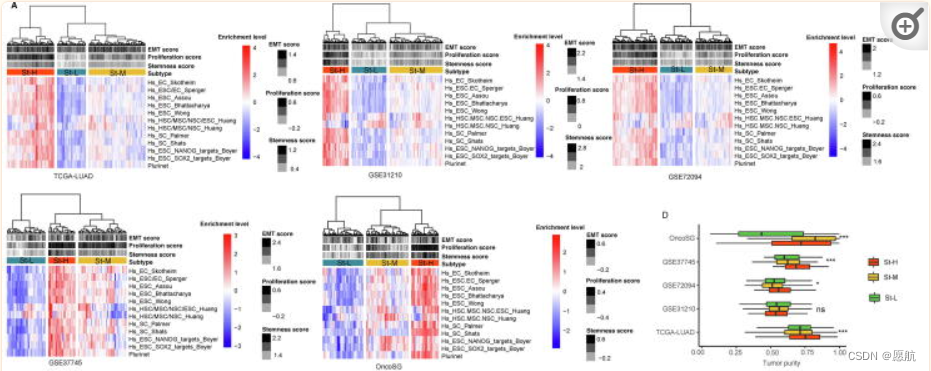
基于 12 个干性特征(基因集),在 5 个数据集(TCGA-LUAD、GSE31210,GSE72094,GSE37745和 OncoSG)做ssGSEA 评分。聚类为三个簇,分别称为 St-H、St-M 和 St-L,它们分别具有高、中和低的干性特征得分 (干性水平遵循以下模式:St-H>St-M>St-L,图1)。St-H和St-L可能分别具有最好和最差的5年OS和/或DFS预后,这与高干性与较差的癌症生存率相关是一致的。肿瘤纯度遵循以下模式:St-H > St-M > St-L (P < 0.05) (图1D),表明高干性大块瘤比低干性大块瘤涉及的肿瘤细胞比例更高。St-H在晚期肿瘤中的比例高于St-L,St-H的TP53突变率高于St-L,St-H的EGFR突变率低于St-L。TP53突变与LUAD的预后较差有关[32],而EGFR突变与LUAD的预后较好有关[33]。此外,St-H的吸烟者比例高于St-L。相比之下,分化特征富集评分遵循以下模式:St-H < St -M < St -L。总而言之,这些结果支持高干性与癌症的不良临床结果有关。拟时序分析,大多数St-H肿瘤处于轨迹的开始期或早期阶段,而大多数St-L肿瘤处于轨迹的终末期或晚期,这表明高干性癌细胞很可能是低干性癌细胞的起源。
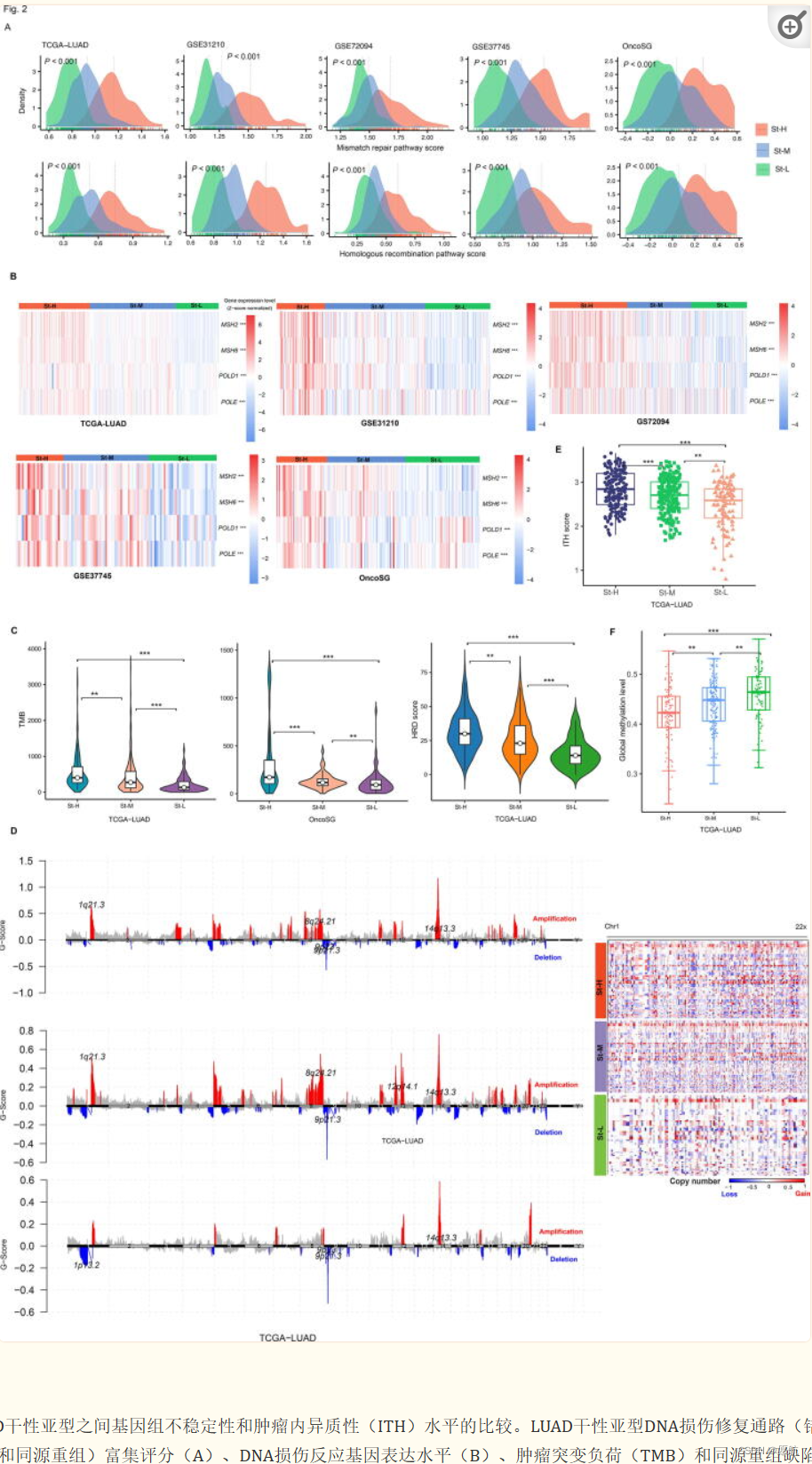
2.LUAD的干性亚型具有不同程度的基因组不稳定性和ITH
DNA损伤修复途径,如错配修复和同源重组,分别在St-H和St-L中具有最高和最低的富集水平。此外,MSH2、MSH6、POLE和POLD1等多个DNA损伤反应基因在St-H和St-L中的表达量分别最高和最低。TMB也遵循以下模式:St-H>St-M>St-L(P < 0.01)同源重组缺陷(HRD)可能导致肿瘤非整倍体[34]。同样,HRD评分显示模式:St-H>St-M>St-L(P < 0.01)拷贝数扩增和缺失的G-score分别在St-H和St-L中最高和最低(图2此外,ST-H的ITH水平最高,St-L的ITH水平最低,即满足St-H>St-M>St-L综上所述,这些结果表明肿瘤干性与基因组不稳定性和ITH呈正相关。有趣的是,St-H的总体甲基化水平[14]最低,而St-L的甲基化水平最高(P < 0.05)。
3.LUAD的干性亚型具有不同的肿瘤免疫微环境和免疫治疗反应
人类白细胞抗原(HLA)基因编码主要组织相容性复合体(MHC),负责免疫调节[35]。我们发现,许多HLA基因的表达水平呈现出以下模式:St-H<St-M<St-L[36]。结果表明,St-L和St-H的抗肿瘤免疫微环境活性最高和最不显著。我们通过TIDE算法预测了LUAD干性亚型对ICI的反应率[37]。有趣的是,St-H往往具有最低的缓解率,而St-L可能在亚型中具有最高的缓解率。此外,我们比较了接受抗PD-1/PD-L1/CTLA-4免疫治疗的5个癌症队列对ICI的反应率,包括Jung队列(NSCLC)[14]、Braun-Miao队列(ccRCC)[15],[16]、Kim队列(BLCA)[17]、Ulloa-Montoya队列(黑色素瘤)[18]和Liu队列(黑色素瘤)[19] ,几乎同上述结果一致。这些结果支持肿瘤干性抑制抗肿瘤免疫反应和免疫治疗反应。

4.LUAD单细胞干性亚型的鉴定
将单细胞数据依据得分,聚类模式为三类(A),看干细胞得分、侵袭、转移都为st-H>st-M>st-l,与先前结果一致(B)。看三组的DNA损伤反应基因(c),再看inferCNV推断出来的恶性肿瘤细胞比例(e)。最妙的为拟时序分析的解释,大多数St-H细胞分布在一个分支中,少数分布在另一个分支(图5相反,St-M和St-L中的单个细胞均匀分布在三个不同的分支中。它再次表明,高干性癌细胞在这些亚型中异质性最小。伪时间分析表明,许多St-H细胞处于轨迹的起点,而大多数St-L细胞处于晚期,许多St-L细胞处于终末状态(图5它表明许多低干细胞来源于高干细胞。此外,我们发现很少有St-H细胞也处于终末状态,这表明新的癌症干细胞可能随着肿瘤的发展而出现。

本文来自互联网用户投稿,该文观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。 如若内容造成侵权/违法违规/事实不符,请联系我的编程经验分享网邮箱:chenni525@qq.com进行投诉反馈,一经查实,立即删除!
- Python教程
- 深入理解 MySQL 中的 HAVING 关键字和聚合函数
- Qt之QChar编码(1)
- MyBatis入门基础篇
- 用Python脚本实现FFmpeg批量转换
- 【分布式】分布式链路跟踪技术
- 众和策略证券开户首选:申购新股怎样才能中签?
- html 基础学习笔记
- 代码随想录算法训练营day18 || 513.找树左下角的值,112.路径总和,106.从中序和后序序列构造二叉树
- pip安装报错SSL
- Unified-IO 2 模型: 通过视觉、语言、音频和动作扩展自回归多模态模型。给大家提前预演了GPT5?
- 优优嗨聚集团:法律行业未来发展:颠覆、创新与无限可能!
- CentOS 8 安装指定版本ansible
- x-cmd pkg | pdfcpu - 强大的 PDF 处理工具
- SSH 密钥身份验证和管理