5+双硫死亡+分型+实验,双硫死亡又上大分。干湿结合拿下5+
今天给同学们分享一篇生信文章“The role of molecular subtypes and immune infiltration characteristics based on disulfidptosis-associated genes in lung adenocarcinoma”,这篇文章发表在Aging (Albany NY)期刊上,影响因子为5.2。

结果解读:
LUAD中与双硫死亡相关的基因(DAG)的表达谱、CNV和体细胞突变鉴定
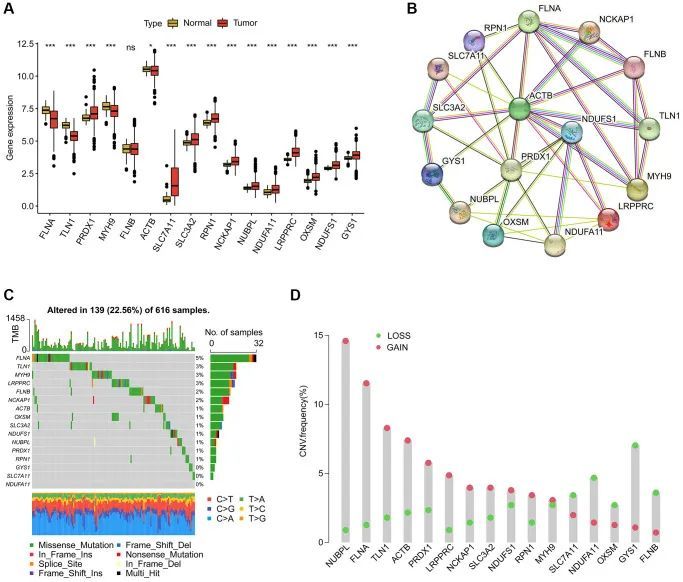
作者确定了16个与双硫死亡相关的基因(DAG),并研究了它们在LUAD进展中的潜在功能。差异表达分析显示这些基因在正常和肿瘤组织之间具有不同的表达模式(图1A)。具体而言,FLNA、TLN1、MYH9和ACTB在肿瘤组织中下调,而PRDX1、SLC7A11、SLC3A2、RPN1、NCKAP1、NUBPL、NDUFA11、LRPPRC、OXSM、NDUFS1和GYS1则过度表达。蛋白相互作用网络分析表明这些基因之间存在潜在的相互作用(图1B)。体细胞突变分析显示,在616个样本中,139个LUAD样本(22.56%)的DAG突变频率有所变化,其中FLNB、LRPPRC、MYH9和TLN1的突变频率分别为6%、3%、3%和3%(图1C)。此外,CNV分析显示NUBPL、FLNA、TLN1、ACTB、PRDX1、LRPPRC、NCKAP1、SLC3A2、NDUFS1和RPN1的CNV扩增,而SLC7A11、NDUFA11、OXSM、GYS1和FLNB则显示更高的CNV缺失(图1D)。这些发现表明DAG表达谱、突变和CNV存在差异,暗示它们在LUAD的癌变过程中可能发挥作用。
LUAD中基于DAG的分子亚型的表征
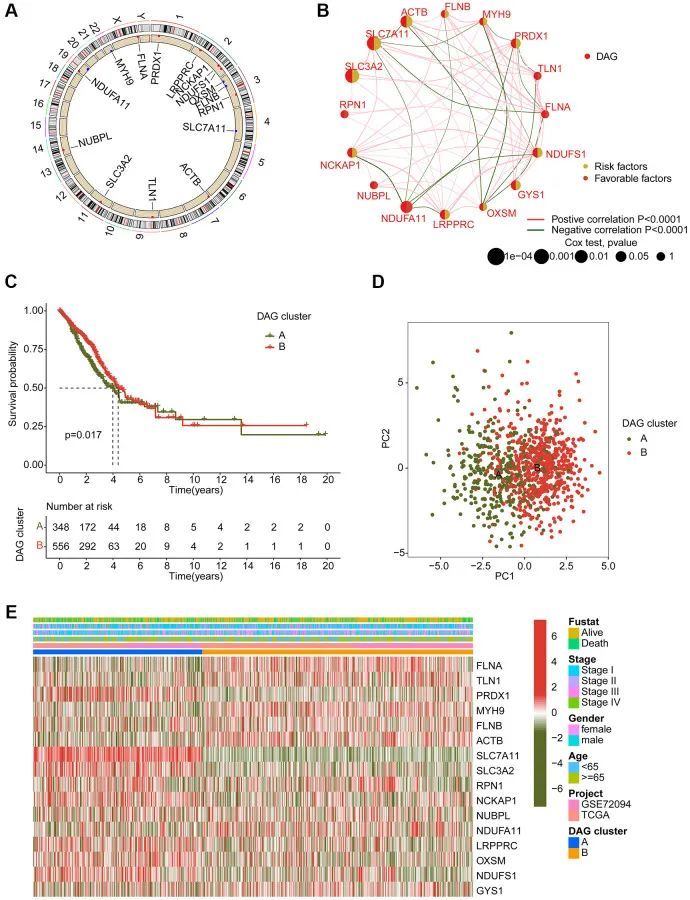
为了确定LAUD的基于DAG的分子亚型,作者从GSE72094收集了397个LAUD样本和从TCGA-LUAD数据集中收集了507个LAUD样本。如图2A所示,使用圆形图来说明染色体上16个DAG的位置。网络图用于展示DAG在LAUD中的关系和预后价值。通过单变量Cox分析获得了9个预后变量,包括一个有利因素(NDUFA11)和8个风险因素(NCKAP1、PRDX1、NDUFS1、LRPPRC、GYS1、ACTB、SLC7A11和SLC3A2)(图2B)。基于16个DAG的表达谱,使用无监督一致性聚类算法成功地鉴定出了两个LAUD样本的分子亚型。值得注意的是,两个基于DAG的分子亚型之间的临床预后存在显著差异,DAG-cluster A中的LAUD样本的临床预后较DAG-cluster B中的样本更差(p = 0.017,图2C)。此外,主成分分析(PCA)图可以清楚地将DAG-cluster A和B中的LAUD样本区分为不同的分布模式,表明基于DAG的分子亚型的独立性(图2D)。热图显示了DAG-cluster A和B中16个DAG的表达与临床变量(生存状态、年龄、性别和分期)之间的关系。在16个DAG的表达谱中观察到明显的差异(图2E)。
DAG基于分子亚型的免疫浸润估计
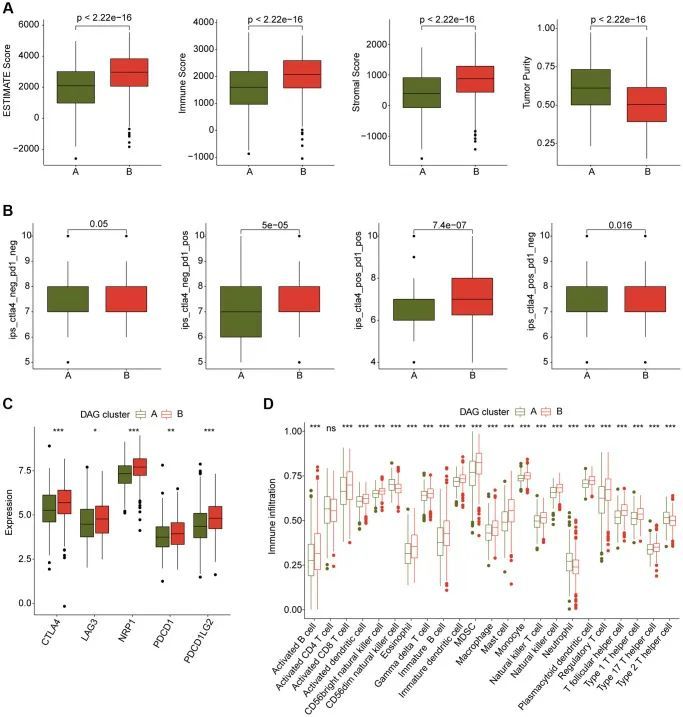
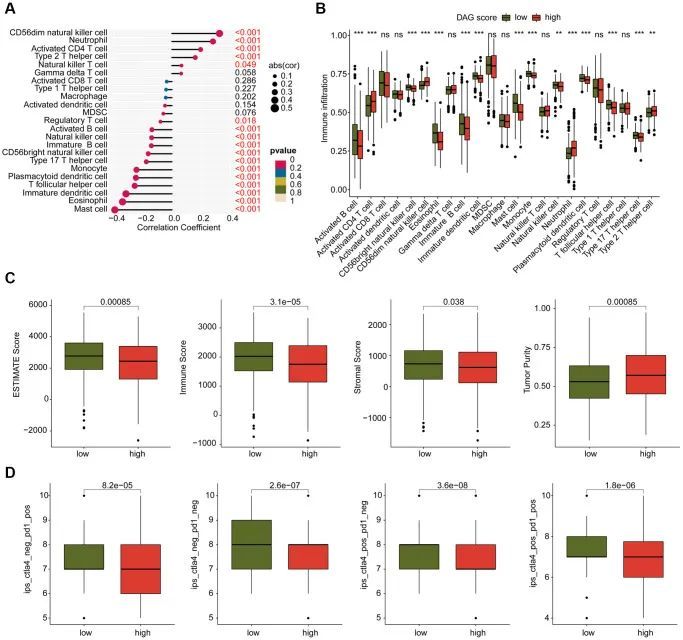
作者还对LUAD样本的DAG基因分型进行了免疫浸润和免疫治疗反应的分析。免疫状态估计的结果显示,在DAG聚类B中临床生存预后较好的LUAD样本具有较高的免疫状态和较低的肿瘤纯度(图3A)。此外,免疫治疗反应评估的结果表明,DAG聚类B中的LUAD样本对PD-1或CTLA-4治疗策略更具响应性(图3B)。免疫检查点结果表明,在DAG聚类B中的LUAD样本中,CTLA-4、LAG3、NRP1、PDCD1和PDCD1LG2的表达显著增高(图3C)。此外,ssGSEA评估显示,在DAG聚类B中的LUAD样本中,大多数免疫细胞的比例显著增高,表明DAG聚类B中的样本具有更高的免疫浸润状态(图3D)。总体而言,作者的发现表明DAG基因分型的LUAD之间的免疫微环境存在显著差异,与免疫治疗反应有关。
LUAD中与DAG相关的DEGs的综合分析
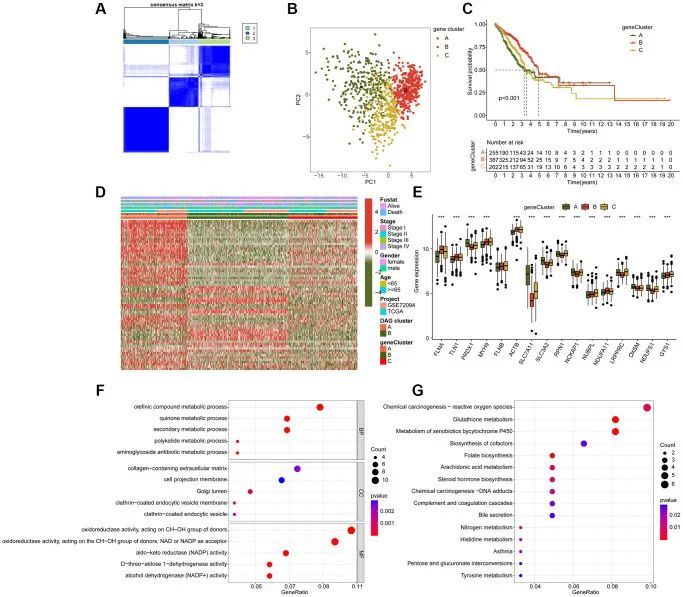
为了进一步研究LUAD中DAG亚型的生物学功能,作者使用“limma”脚本进行差异分析,以识别基于DAG的亚型中的差异表达基因(DEGs)。共鉴定出107个DEGs用于共识聚类分析,探索了三个基因亚型亚型,其中基因亚型A有255个样本,基因亚型B有387个样本,基因亚型C有262个样本(图4A)。主成分分析图也展示了LUAD样本在基因亚型亚型中的独立分布模式(图4B)。临床结果分析表明,与基因亚型A和C相比,基因亚型B中的LUAD样本具有更好的预后概率(p < 0.001,图4C)。如图4D所示,热图图示了DEGs表达与临床病理特征之间的关系。此外,作者还观察到基因亚型亚型中DAG表达的显著差异,如FLNA、TLN1、PRDX1和MYH9(图4E)。GO富集分析表明,差异表达基因参与代谢相关的生物功能,如烯烃化合物代谢过程、醌代谢过程和次生代谢过程(图4F)。此外,KEGG结果显示差异表达基因富集在化学致癌-活性氧物质、谷胱甘肽代谢和细胞色素P450代谢异物质过程中(图4G)。
基于DAG相关的差异表达基因的预后标志的构建
作者进行了一项分析,评估了与LUAD相关的DAG相关DEGs的预后价值。具体而言,作者进行了单变量Cox分析,并确定了52个具有p < 0.05的预后因子,其中包括21个有利因子和31个风险因子(图5A)。使用“glmnet”软件包,作者进一步进行了LASSO分析,并从52个预后因子中选择了16个重要变量(图5B)。基于多变量Cox分析,作者建立了一个包含7个独立预后因子的预后风险模型,并计算了LUAD样本的DAG得分。在DAG聚类亚型中,作者观察到DAG聚类B中临床预后较好的LUAD样本具有较低的DAG得分(图5C)。类似地,在基因聚类亚型中,作者发现存活预后较长的LUAD样本具有较低的DAG得分,这表明DAG得分与LUAD样本的临床结果可能存在潜在关联(图5D)。流动图说明了DAG得分与DAG聚类亚型和基因聚类亚型中临床预后之间的潜在关系(图5E)。具体而言,具有良好临床生存结果的LUAD样本倾向于分为低DAG得分组,并与更好的生存结果相关。
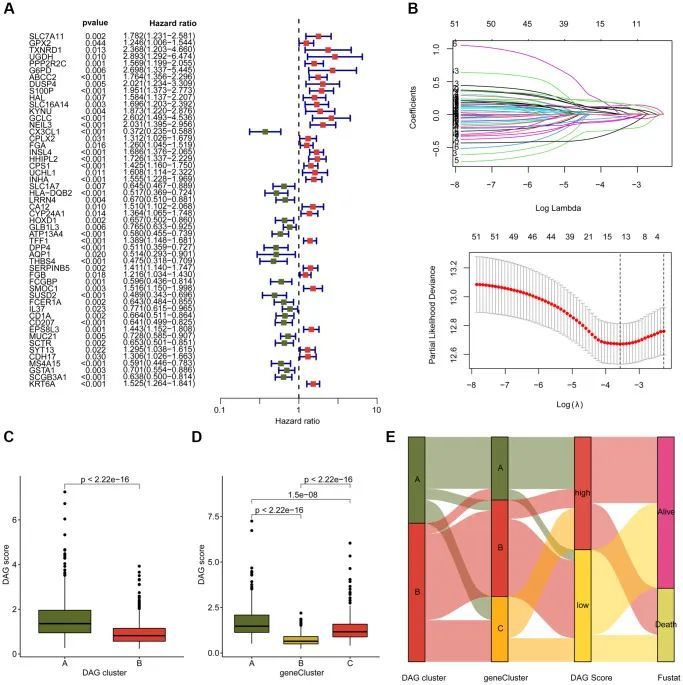
DAG预后标志的开发和验证
为了研究DAG得分与LUAD样本的临床结果预后之间的潜在关联,使用“caret”脚本将样本按7:3的比例分为训练组和测试组。然后根据训练组和测试组中的DAG得分中位数将样本分为低DAG得分组和高DAG得分组。独立队列中LUAD样本的临床结果表明,低DAG得分组的预后明显优于高DAG得分组(图6A),此外,整个队列的临床生存结果显示,低DAG评分组的生存结果优于高DAG评分组(图6C)。在训练队列中,一年、三年和五年的ROC曲线下面积分别为0.693、0.677和0.652;在测试队列中,分别为0.737、0.710和0.605;在整个队列中,分别为0.709、0.686和0.630(图6D-6F)。此外,主成分分析图清楚地将低和高DAG评分的LUAD样本分为两个不同的分布模式,无论是在训练、测试还是整个队列中(图6G-6I)。这些发现表明,DAG预后标志能够准确地将LUAD样本分类为不同的风险亚型,并与临床生存结果相关。
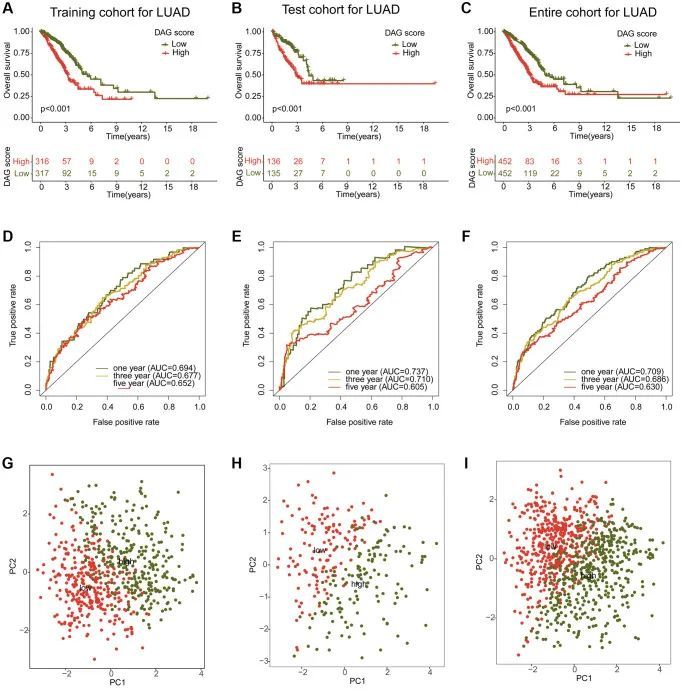
不同临床病理特征中DAG的综合分析
作者进一步研究了DAG得分与各种临床病理特征的关系。如图7A所示,DAG得分与性别、分期和临床生存状况之间存在显著差异。随后,作者评估了DAG得分在不同临床变量中的预后价值,并发现在不同年龄、性别和分期组中,DAG得分高的LUAD样本的生存结果较差,与DAG得分低的样本相比(图7B-7D)。
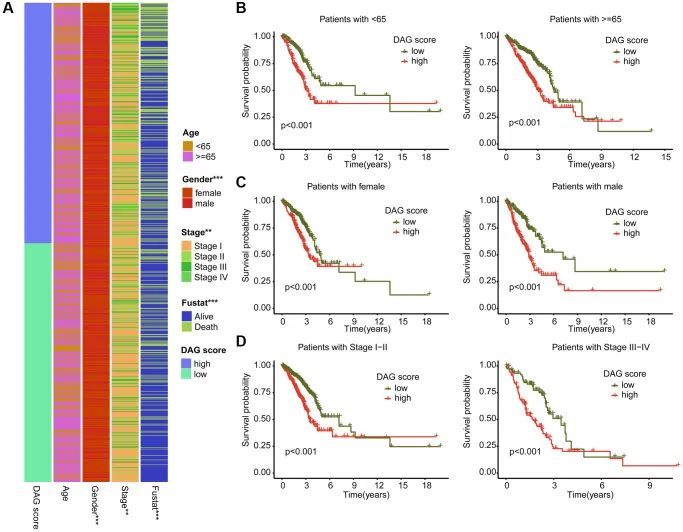
DAG评分的Nomogram制作和独立预后分析
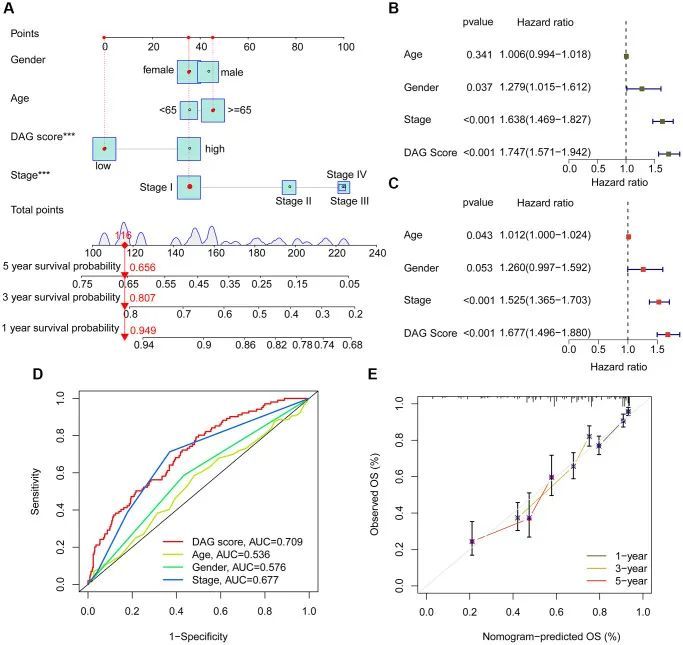
利用TCGA-LUAD和GSE72094数据集中的综合临床信息,作者开发了一个预测LUAD样本在一年、三年和五年存活能力的Nomogram,基于DAG得分和临床变量(图8A)。单变量Cox分析显示,性别(HR = 1.279,95% CI = 1.015–1.612,P = 0.037)、分期(HR = 1.638,95% CI = 1.469–1.827,P < 0.001)和DAG得分(HR = 1.747,95% CI = 1.571–1.942,P < 0.001)被认为是LUAD的风险因素(图8B)。多变量Cox分析显示,分期(HR = 1.525,95% CI = 1.365–1.703,P < 0.001)和DAG得分(HR = 1.677,95% CI = 1.496–1.880,P < 0.001)是LUAD的独立预后预测因子(图8C)。ROC曲线显示,DAG得分、年龄、性别和分期的曲线下面积(AUC)分别为0.709、0.536、0.576和0.677,表明DAG得分对LUAD具有良好的诊断能力(图8D)。此外,一年、三年和五年的校准曲线显示实际存活概率与Nomogram预测的存活概率之间具有最佳一致性(图8E)。
DAG评分亚型中免疫浸润和免疫治疗反应的估计
作者对DAG得分与免疫浸润之间的关系进行了调查。如图9A所示,作者观察到DAG得分与免疫浸润之间存在显著相关性。具体而言,DAG得分与CD56dim自然杀伤细胞、中性粒细胞、CD4 T细胞和2型T辅助细胞呈正相关,而与肥大细胞、嗜酸性粒细胞、未成熟树突状细胞、T滤泡辅助细胞和浆细胞样树突状细胞呈负相关。作者对ssGSEA结果的分析显示,高DAG得分组中大多数免疫细胞的比例较低,表明高DAG得分的LUAD样本处于免疫抑制状态(图9B)。此外,基于ESTIMATE算法,高DAG得分组的ESTIMATE、免疫和基质成分得分较低,肿瘤纯度较高(图9C)。此外,作者利用TCIA数据库评估了不同DAG得分亚型的LUAD样本的免疫治疗反应,并发现低DAG得分的样本对PD-1和CTLA-4治疗策略更具响应性(图9D)。这些发现表明DAG评分与免疫浸润之间可能存在关联,并强调了基于DAG评分亚型预测LUAD免疫治疗反应的可能性。
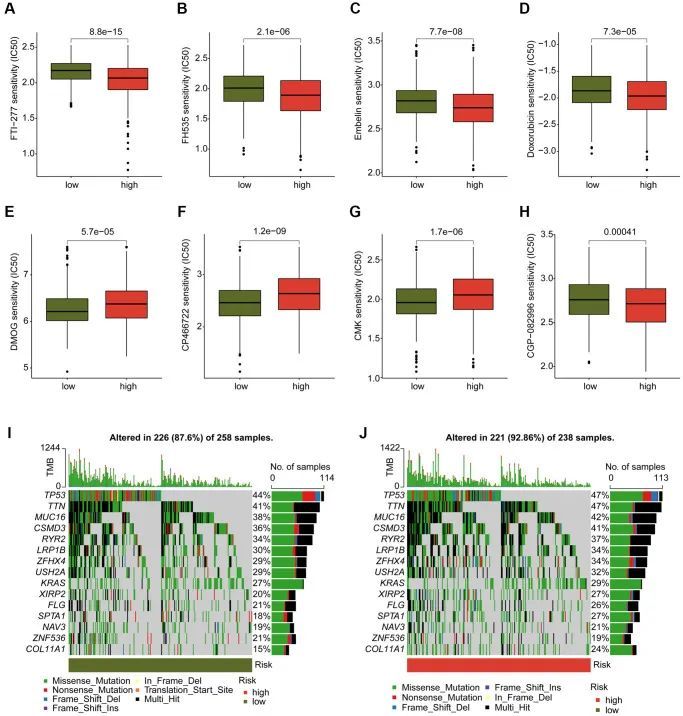
化疗药物评估和肿瘤突变负荷特征
作者对几种可能有益于LUAD治疗的化疗药物进行了评估,涉及不同的DAG评分亚型。如图10A-10H所示,作者观察到DAG评分高的LUAD样本对FTI-277、FH535、Embelin、Doxorubicin和CGP-082996的IC50值较低,而DAG评分高的LUAD样本对DMOG、CP466722和CMK的IC50值较高。此外,作者还探索了DAG评分亚型中LUAD样本的TMB特征。作者发现,在低DAG评分组中的258个LUAD样本中,有226个样本(87.6%)存在体细胞突变,而在高DAG评分组的238个LUAD样本中,有221个样本(92.86%)存在体细胞突变(图10I,10J)。作者的突变频率结果表明,DAG评分高的LUAD样本具有更高的体细胞突变频率,包括TP53(47%)、TTN(47%)、MUC16(42%)和CSMD3(41%)。
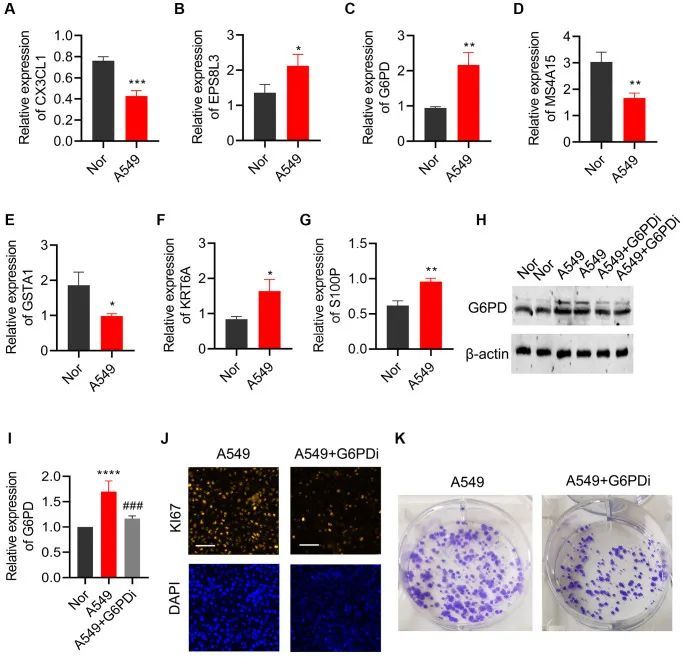
G6PD的下调可以抑制肺癌细胞的增殖和克隆
qPCR被用于验证在肺癌细胞系(A549)和正常支气管上皮细胞系(BEAS-2B)中筛选出的7个关键基因的表达。结果显示,在肺癌细胞中,CX3CL1、MS4A15和GSTA1明显下调,而EPS8L3、G6PD、KRT6A和S100P明显上调,与生物信息学分析结果一致(图11A-11G)。由于G6PD在肺癌中显示出最高的风险系数,因此研究了G6PD下调对肺癌细胞增殖和集落形成的影响。Western Blot分析显示,与BEAS-2B组相比,A549细胞中G6PD的表达显著增加,与qPCR结果一致。使用G6PD抑制剂G6PDi处理可以有效降低肺癌细胞中的G6PD表达(图11H,11I)。Ki67染色和集落形成实验的结果表明,干扰G6PD可以显著抑制肺癌细胞的增殖能力(图11J,11K)。
总结
总之,作者基于双硫死亡基因进行了聚类分型,并分析了双硫死亡亚型的差异基因。随后,作者使用了七个差异基因来构建一个预后风险模型,并验证了该模型对LUAD患者预后的预测价值。作者的研究目的是进一步探索LUAD的预后标志物。与其他研究一起,扩展的生物标志物库可以进一步应用于特定基因亚型的筛选。已经证明,具有特定生物标志物的LUAD亚型有助于发现临床相关的易感性。此外,对未来选择的生物标志物如G6PD的分子机制进行进一步探索将有助于加深对LUAD发病机制的理解。
本文来自互联网用户投稿,该文观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。 如若内容造成侵权/违法违规/事实不符,请联系我的编程经验分享网邮箱:chenni525@qq.com进行投诉反馈,一经查实,立即删除!