易基因:ChIP-seq等揭示Runx2通过转录调控Itgav表达激活肝星状细胞以促进肝纤维化|科研进展
这里是专注表观组学十余年,领跑多组学科研服务的易基因。
肌成纤维细胞(myofibroblasts)主要由肝脏中活化的肝星状细胞(hepatic stellate cells HSC)组成,在肝纤维化进展中发挥着核心作用。由于肌成纤维细胞主要负责细胞外基质蛋白的合成、沉积和重塑,因此靶向HSC被认为是肝纤维化治疗的一种新策略,并且正在进行越来越多的临床前研究和临床试验。先前的研究表明,runt相关转录因子2 (Runx2)与非酒精性脂肪性肝病的发生发展相关,但其在肝星状细胞活化和肝纤维化中的具体作用尚不清楚。
2023年7月5日,重庆医科大学附属第一医院邓亮博士团队在《Clin Transl Med》杂志发表题为“Runx2 activates hepatic stellate cells to promote liver fibrosis via transcriptionally regulating Itgav expression”的研究论文,该研究以人和小鼠的肝星状细胞(hepatic stellate cells HSC)为研究对象,通过RNA-seq和ChIP-seq等分析揭示Runx2在肝纤维化过程中通过转录调控Itgav((integrin alpha-V)表达对HSC活化至关重要,提示Runx2可能是肝纤维化的一个潜在治疗靶点。

标题:Runx2 activates hepatic stellate cells to promote liver fibrosis via transcriptionally regulating Itgav expression(Runx2通过转录调控Itgav表达活化肝星状细胞以促进肝纤维化)
时间:2023-07-05
期刊:Clinical and Translational Medicine
影响因子:IF 10.6
技术平台:ChIP-seq、RNA-seq、Western blot、qRT-PCR等
研究摘要:
本研究分析结果表明,Runx2表达在不同病因的人肝纤维化中显著上调;在小鼠肝纤维化过程中,Runx2表达也逐渐上调,且Runx2主要在活化的HSC中表达。HSC中Runx2敲除可以显著减少由CCl4诱导、由1,4-二氢-2, 3,5-吡啶二甲酸二乙酯(3,5-diethoxycarbonyl-1,4-dihydrocollidine)(DDC)诱导、由蛋氨酸胆碱缺乏症(MCD)诱导的肝纤维化,而肝通过注射HBAAV-Runx2或VA-Lip-Runx2的Runx2过表达加剧了CCl4诱导的肝纤维化。体外实验分析表明,Runx2促进HSC的活化和增殖,而在HSC中Runx2的敲除则抑制了这些作用。RNA-seq和Runx2的ChIP-seq分析表明,Runx2可以通过与其启动子结合以促进整合素α - v (integrin alpha-V,Itgav)表达。阻断Itgav表达可减少Runx2诱导的HSC活化和肝纤维化。此外研究还揭示了细胞因子(TGF-β1、PDGF、EGF)通过蛋白激酶A(PKA)促进HSC中Runx2表达和核转位(nuclear translocation)。
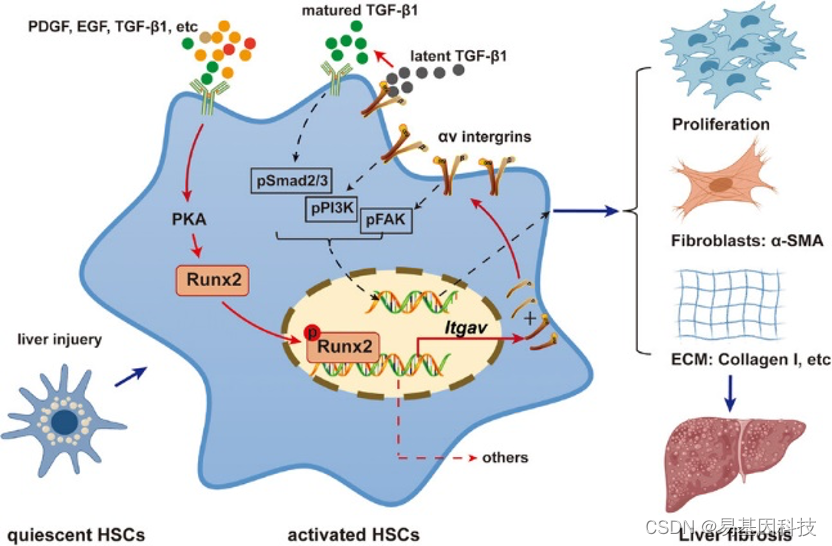
Runx2促进HSC活化和肝纤维化过程的示意图
研究结果
(1)Runx2表达在肝纤维化过程中逐渐上调
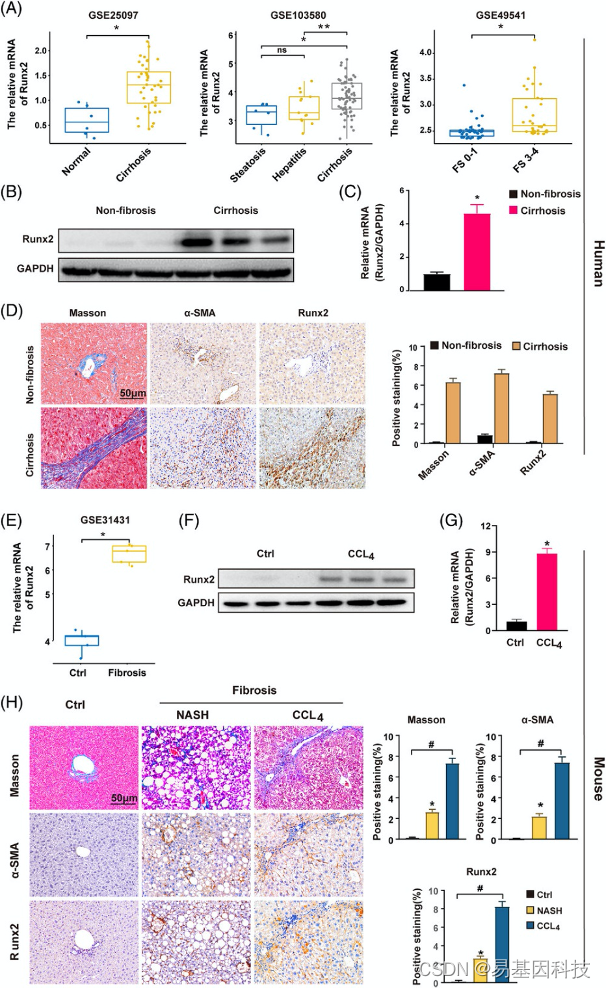
图1:Runx2表达在肝纤维化发展过程中逐渐上调。
(A) 与对照样本相比,Runx2在GSE25097队列的人肝硬化组织(左)、GSE103580队列的酒精性肝炎或肝硬化的人肝脏组织(中)以及GSE49541队列的不同纤维化阶段(FS)的人肝纤维化组织(右)中的mRNA表达。
(B-C) Western blot分析和qRT-PCR检测人非纤维化或肝硬化肝样品中Runx2的蛋白和mRNA水平(n=3)。
(D) 从非纤维化或肝硬化患者采集人肝脏组织样本。对各组肝脏组织中代表性的Masson组织学、α-SMA和Runx2的IHC染色分析。ImageJ软件定量检测阳性染色区域。比例尺:50μm(n=10)。
(E) 与对照样品相比,Runx2在GSE31431小鼠肝纤维化组织中的mRNA表达。
(F-G)腹腔注射CCl4(5μL/G体重)诱导小鼠肝纤维化4周。Western blot和qRT-PCR分析肝脏组织Runx2的蛋白和mRNA水平(n=3)。
(H) 小鼠被喂食高脂肪饮食12个月以诱导NASH相关纤维化。IP注射CCl4诱导小鼠肝纤维化4周。对各组肝脏组织中代表性Masson组织学、α-SMA和Runx2的IHC染色。ImageJ软件定量测量阳性染色区域。比例尺:50μm(n=6)。数据为平均值±SEM,*p、**p<0.05与对照组比较#p<0.01;ns,不显著。
(2)Runx2特异性位于体内活化的HSC中,并在体外HSC活化过程中以时间依赖性方式增加
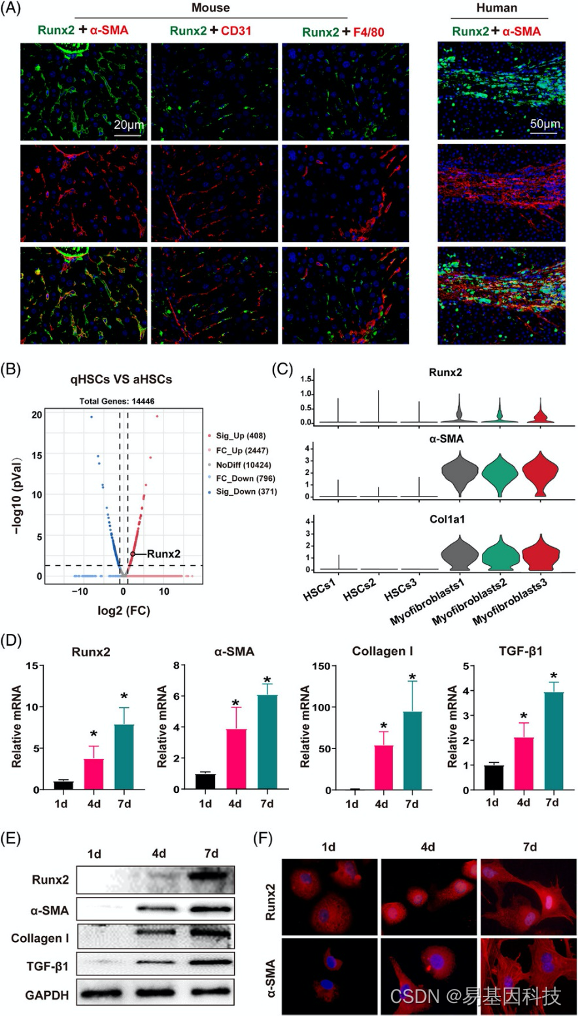
图2:Runx2在体内特异性位于活化的HSC中,并在体外HSC活化过程中以时间依赖性方式增加。
(A) CCl4处理的小鼠和肝硬化患者肝切片的免疫荧光显微图,活化HSC(α-SMA,红色)、内皮细胞(CD31,红色)和Kupffer细胞(F4/80,红色)染色,Runx2为绿色。比例尺:小鼠20μm;50μm(n=3)。
(B) 以olive或CCl4处理小鼠4周后,分离出原代HSC,然后RNA-seq分析检测沉默HSC(qHSC,olive)和活化HSC(aHSC,CCl4),并进行火山图分析。
(C) 小提琴图显示了每个聚类所选标记基因(Runx2、α-SMA和Col1a1)的相对表达;平均每个条件1000个细胞。
(D-E)从正常小鼠肝脏中分离原代HSC,并在指定时间间隔(第1、4和7天)培养。Western blot和qRT-PCR检测Runx2、α-SMA、I型胶原(collagen I)和TGF-β1的蛋白和mRNA表达(n=5)。
(F) Runx2和α-SMA在指定时间间隔培养的原代HSC中的免疫荧光染色。显示高倍图像(n=3)。数据为平均值±SEM,与对照组相比*p<0.05。
(3)HSC特异性敲除Runx2可以减少CCl4诱导、DDC诱导或MCD诱导的小鼠肝纤维化
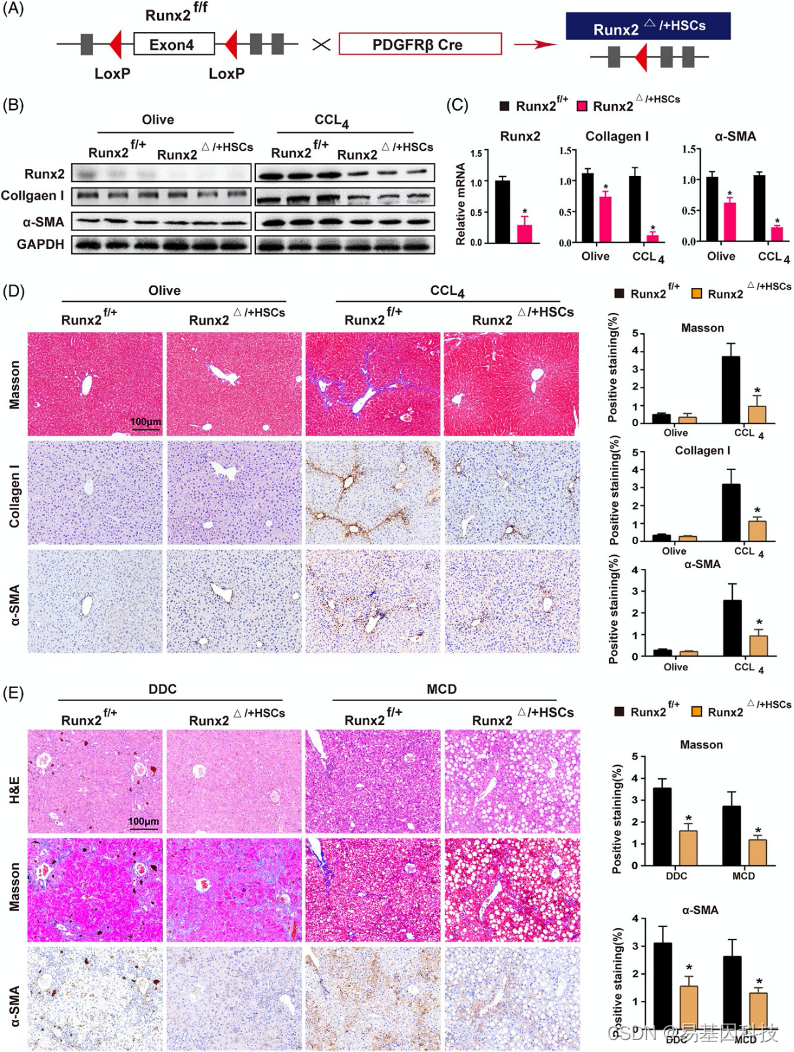
图3:HSC特异性敲除Runx2可以减少CCl4诱导、DDC诱导或MCD诱导的小鼠肝纤维化。
(A) 小鼠HSC特异性敲除Runx2的构建策略示意图(Runx2△+HSC)。
(B-C)用olive或CCl4处理HSC小鼠4周,利用Western blot和qRT-PCR分析Runx2、I型胶原和α-SMA在Runx2f+ 和Runx2△+HSC中的蛋白质和mRNA水平(n=3)。
(D) 用olive或CCl4处理的Runx2f+和Runx2小鼠肝脏组织中I型胶原和a-SMA的Masson和IHC染色的代表性显微图。比例尺:100μm(n=5)。
(E) Runx2f+和Runx2△+HSC小鼠用0.1%的DDC喂养4周以诱导胆汁淤滞,或用MCD喂养8周以诱导NASH。显示了a-SMA的H&E、Masson和IHC染色的代表性显微图。比例尺:100μm(n=3)。
(4)Runx2过表达加剧了CCl4诱导的肝纤维化
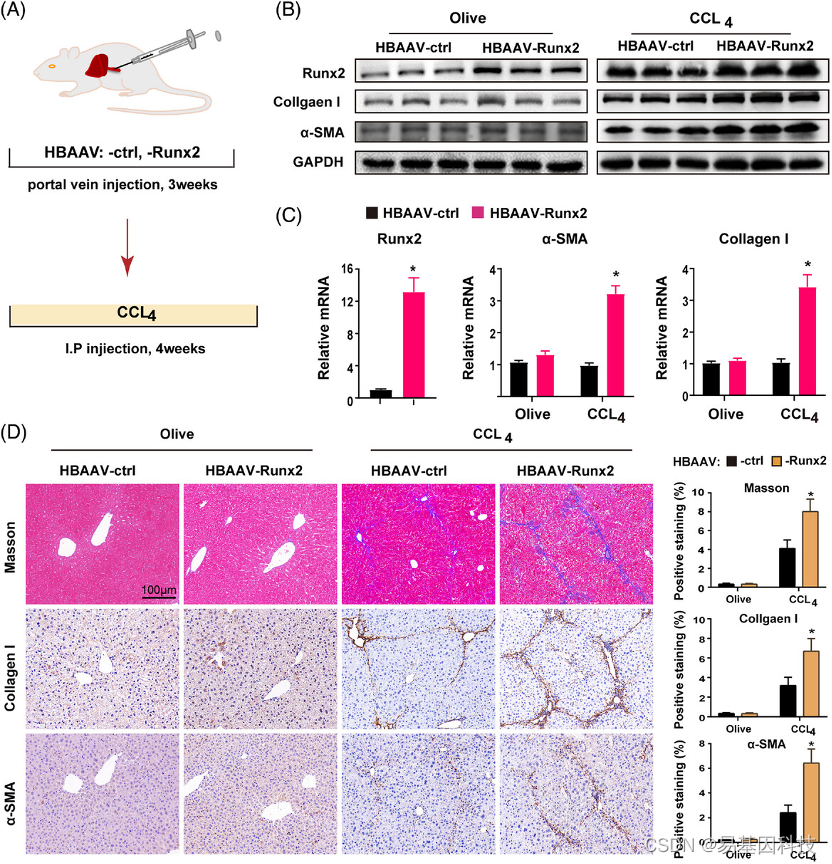
图4:Runx2过表达加剧了CCl4诱导的肝纤维化。
(A) Runx2在肝纤维化中过表达的实验设计示意图。小鼠在通过HBAAV-ctrl或HBAAV-Runx2(100μL/只,1×1012 V g/mL,门静脉)注射3周后,连续4周注射olive或CCl4。
(B-C)Western blot和qRT-PCR检测Runx2、I型胶原和α-SMA的蛋白和mRNA表达(n=3)。
(D) 经olive或CCl4处理的HBAAV-ctrl或HBAAV-Runx2小鼠中胶原I和a-SMA的Masson和IHC染色的代表性图像。比例尺:100μm(n=5)。
(5)Runx2在体外调控HSC活化
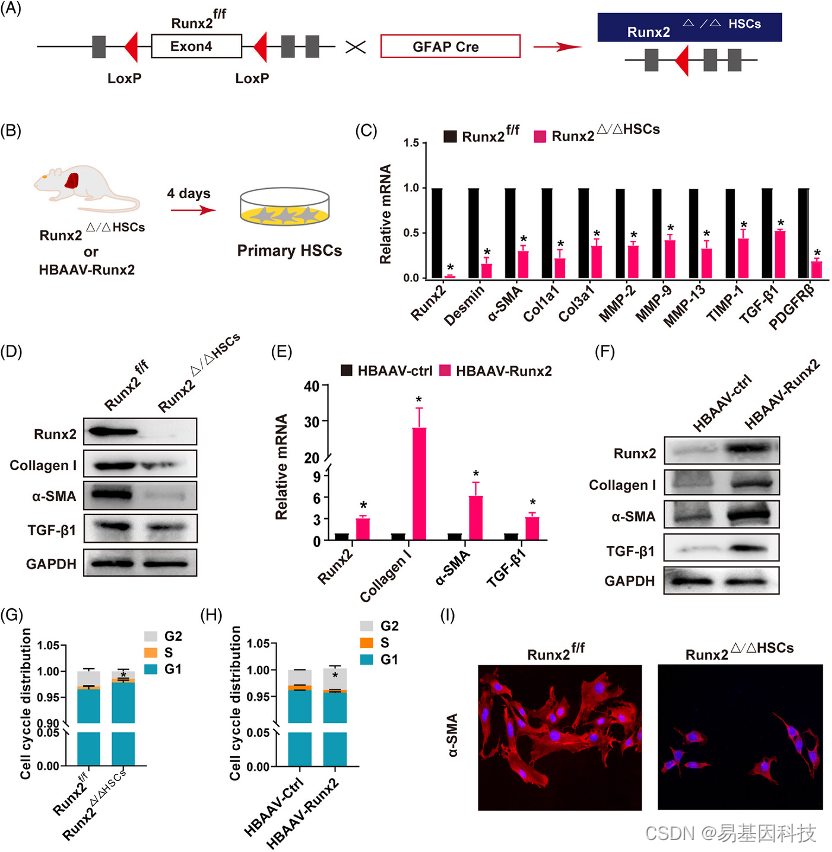
图5:Runx2在体外调控HSC活化。
(A) Runx2小鼠的HSC特异性缺失策略示意图(Runx2△/△HSC)。
(B) 从Runx2△/△HSC或HBAAV-Runx2小鼠中分离出原代HSC,并在3%FBS条件下培养4天。
(C) 从Runx2f/f 或 Runx2△/△HSC小鼠中分离的原代HSC,通过qRT-PCR测定纤维相关基因。
(D) Runx2、α-SMA、I型胶原和TGF-β1在Runx2f/f或Runx2△/△HSC小鼠中分离的原代HSC中的Western blot分析。
(E-F)通过qRT-PCR和Western blot分析从HBAAV-ctrl或HBAAV-Runx2小鼠中分离的原代HSC中Runx2、α-SMA、I型胶原和TGF-β1的mRNA和蛋白表达。
(G-H)通过流式细胞术分析原代HSC中各个细胞周期阶段的指数生长百分比。
(I) 从Runx2f/f或Runx2△/△HSC小鼠中分离的原代HSC,通过免疫荧光染色检测α-SMA活化特征(n=3)。
(6)Itgav是Runx2在肝纤维化中的直接下游靶点
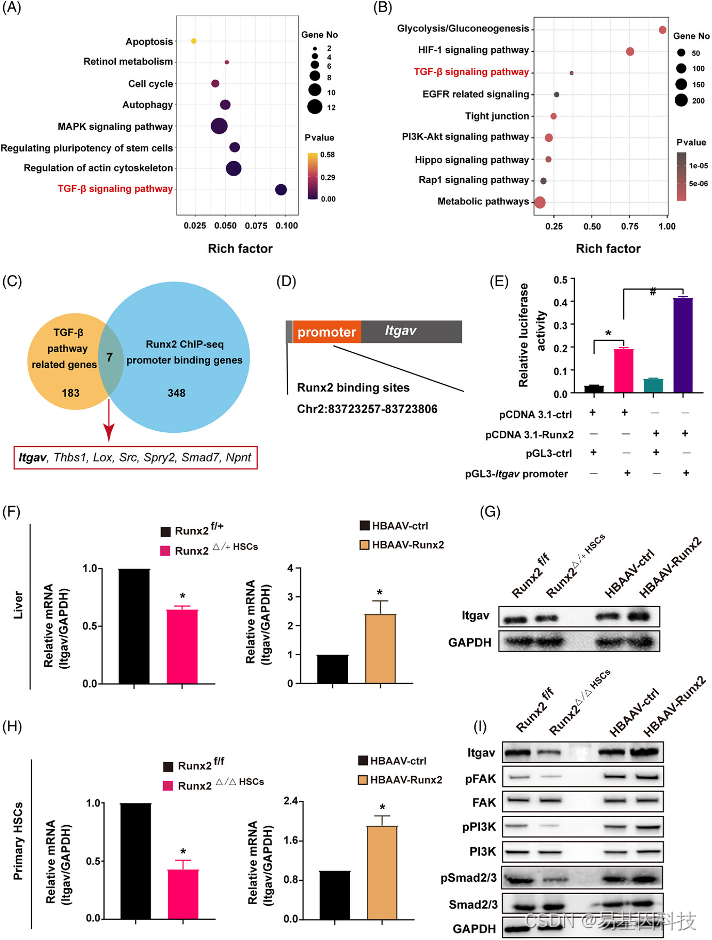
图6:Itgav(integrin alpha-V)是Runx2在肝纤维化中的直接下游靶点。
(A) 对用Runx2或Scramble siRNA转染并培养3天的原代HSC进行RNA-seq分析,并对差异表达基因(DEG)进行KEGG通路富集分析。
(B) 对从HBAAV-Runx2小鼠分离的原代HSC进行Runx2 ChIP-seq分析,并对DEG进行KEGG通路富集分析。
(C) 通过ChIP-seq分析,对348个启动子与Runx2结合基因和183个TGF-β通路相关基因进行交叉分析。
(D) 基因组图谱显示Itgav转录启动子区的Runx2结合位点(Chr2:8372357-83723806)。
(E) 经pCDNA 3.1-ctrl或pCDNA 3.1-Runx2转染的小鼠HSC细胞系上进行荧光素酶报告基因分析。
(F-G) 经CCl4处理4周的Runx2f/+、Runx2△/+HSC、HBAAV-ctrl和HBAAV-Runx2小鼠中采集肝脏组织。通过qRT-PCR和Western blot分析Itgav的mRNA和蛋白表达。
(H-I) 分别从Runx2f/f小鼠、Runx2△/△HSC小鼠、HBAAV-ctrl小鼠和HBAAV-Runx2小鼠中分离出原代HSC。用qRT-PCR分析Itgav的mRNA表达。Western blot分析Itgav及其下游激酶(FAK、pFAK、PI3K、pPI3K,Smad2/3和pSmad2/3)的蛋白表达。数据为平均值±SEM;n=3, *p<0.05,#p<0.05。
(7)αv整合素抑制剂阻断Runx2过表达引起的CCl4诱导肝纤维化加剧
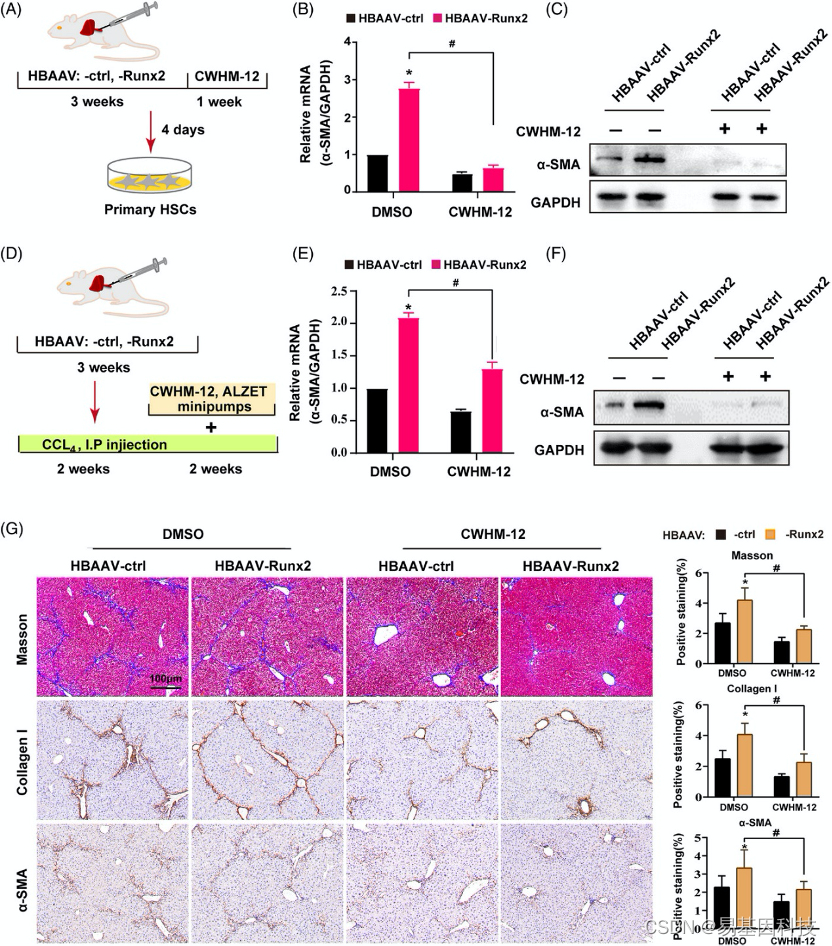
图7:αv整合素抑制剂阻断Runx2过表达引起的CCl4诱导肝纤维化加重。
(A) αv整合素抑制剂CWHM 12体外实验的靶向处理方案。HBAAV-ctrl小鼠或HBAAV-Runx2小鼠给予CWHM-12(100mg/kg/天)或安慰剂(载体)处理1周,然后分离原代HSC。
(B-C)Western blot和qRT-PCR分析原发性HSC中α-SMA的蛋白质和mRNA表达水平(n=3)。
(D) CWHM-12体内实验的靶向处理方案。小鼠服用CCl4 2周,然后插入含有CWHM-12(100mg/kg/天)或安慰剂(载体)的Alzet微型泵,随后再服用2周CCl4。
(E-F)qRT-PCR和Westernblot分析检测用或不用CWHM-12处理的HBAAV-Runx2或HBAAV-ctrl小鼠的肝脏组织中α-SMA的mRNA和蛋白表达(n=3)。
(G) I型胶原和α-SMA的Masson和IHC染色的代表性显微图。比例尺:100μm(n=5)
(8)PKA调控HSC中Runx2的活化和核转位(nuclear translocation)
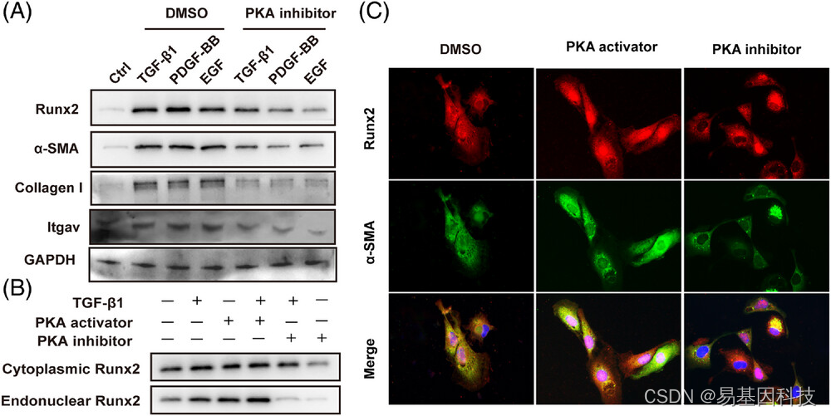
图8:PKA介导的Runx2活化和HSC核转位。
(A) 经或不经TGF-β1(5 ng/mL)、PDGF-BB(5 ng/mL)、EGF(5 mg/mL)处理,然后用DMSO或PKA抑制剂(PKI-6-22,10 nM/mL)处理12小时的原代HSC中Runx2、α-SMA、I型胶原和Itgav的Western blot分析(n=3)。
(B) 经或不经TGF-β1,然后用PKA活化剂(8-Bromo-cAMP,0.5 nM/mL)或抑制剂(n=3)处理的原代HSC中细胞质和细胞核内Runx2的Western blot分析。
(C) PKA抑制剂或活化剂处理的原代HSC中Runx2和α-SMA的免疫荧光染色(n=3)。
关于易基因染色质免疫共沉淀测序?(ChIP-seq)
染色质免疫共沉淀(Chromatin Immunoprecipitation,ChIP),是研究体内蛋白质与DNA相互作用的经典方法。将ChIP与高通量测序技术相结合的ChIP-Seq技术,可在全基因组范围对特定蛋白的DNA结合位点进行高效而准确的筛选与鉴定,为研究的深入开展打下基础。
DNA与蛋白质的相互作用与基因的转录、染色质的空间构型和构象密切相关。运用组蛋白特定修饰的特异性抗体或DNA结合蛋白或转录因子特异性抗体富集与其结合的DNA片段,并进行纯化和文库构建,然后进行高通量测序,通过将获得的数据与参考基因组精确比对,研究人员可获得全基因组范围内某种修饰类型的特定组蛋白或转录因子与基因组DNA序列之间的关系,也可对多个样品进行差异比较。
应用方向:
ChIP 用来在空间上和时间上不同蛋白沿基因或基因组定位
- 转录因子和辅因子结合作用
- 复制因子和 DNA 修复蛋白
- 组蛋白修饰和变异组蛋白
技术优势:
- 物种范围广:细胞、动物组织、植物组织、细菌微生物多物种富集经验;
- 微量建库:只需5ng以上免疫沉淀后的DNA,即可展开测序分析;
- 方案灵活:根据不同的项目需求,选择不同的组蛋白修饰特异性抗体。
技术路线:
易基因提供全面的DNA与蛋白互作测序方案,详询易基因:0755-28317900.
参考文献:
Zhong L, Zhao J, Huang L, Liu Y, Pang X, Zhan K, Li S, Xue Q, Pan X, Deng L. Runx2 activates hepatic stellate cells to promote liver fibrosis via transcriptionally regulating Itgav expression. Clin Transl Med. 2023 Jul;13(7):e1316.
相关阅读:
科研进展:ChIP-seq等揭示转录因子NRF1调控原始生殖细胞发育、增殖和存活的表观遗传机制
项目集锦 | 易基因近期染色质免疫共沉淀测序(ChIP-seq)研究成果
本文来自互联网用户投稿,该文观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。 如若内容造成侵权/违法违规/事实不符,请联系我的编程经验分享网邮箱:chenni525@qq.com进行投诉反馈,一经查实,立即删除!
- Python教程
- 深入理解 MySQL 中的 HAVING 关键字和聚合函数
- Qt之QChar编码(1)
- MyBatis入门基础篇
- 用Python脚本实现FFmpeg批量转换
- 中国500米逐年植被净初级生产力(NPP)数据集(2000-2022)
- 白话Kubernetes网络
- vivado 定义板文件板
- 从零学Java 集合概述
- ZYNQ 7020 PL feature 解读
- 基于若依的ruoyi-nbcio流程管理系统一种简单的动态表单模拟测试实现(五)
- 配置文件管理:实现高效、智能的配置监控与报表统计
- VUE生命周期和生命周期四个阶段
- 机器学习分类模型
- 【毕业设计】-- 如何使用Visio画系统功能结构图