这才是单基因泛癌的正确切入姿势。干湿结合精准拿下5+
今天给同学们分享一篇生信文章“Pan-Cancer Analysis and Experimental Validation of SOX4 as a Potential Diagnosis, Prognosis, and Immunotherapy Biomarker”,这篇文章发表在Cancers (Basel)期刊上,影响因子为5.2。

结果解读:
SOX4在不同肿瘤类型中的表达
作者首先通过TIMER工具根据TCGA数据比较了SOX4 mRNA的表达情况。如图1a所示,与相邻正常组织相比,SOX4在包括BLCA、BRCA、CHOL、COAD、ESCA、GBM、HNSC-HPV+、HNSC、KIRP、LIHC、LUAD、LUSC、PCPG、PRAD、READ、STAD、THCA和UCEC在内的18种肿瘤类型或特定癌症亚型中表达显著增加,但在KICH和KIRC中显著降低。在CESC、PAAD和SKCM中没有统计学上显著差异。考虑到TCGA数据库中正常数据的有限性,作者整合了TCGA和GTEx数据,研究了九种肿瘤类型中SOX4 mRNA表达的差异。如图1b所示,与相邻正常组织相比,SOX4在DLBC、LAML、LGG、TGCT、THYM和UCS中表达显著增加。然而,在ACC、OV和SARC中没有统计学上显著差异。此外,作者还使用UALCAN的“CPTAC分析”模块对乳腺癌、结肠癌、卵巢癌、透明细胞肾癌、UCEC、LUAD和儿童脑癌的SOX4蛋白表达进行了分析。如图1c所示,与相邻的正常组织相比,SOX4蛋白在乳腺癌、LUAD和UCEC中明显增加。其他肿瘤类型中没有关于SOX4的信息。作者还评估了SOX4表达与肿瘤病理分期之间的相关性。发现SOX4表达与ESCA、LIHC、PAAD、SKCM和THCA的病理分期显著相关(图1d)。
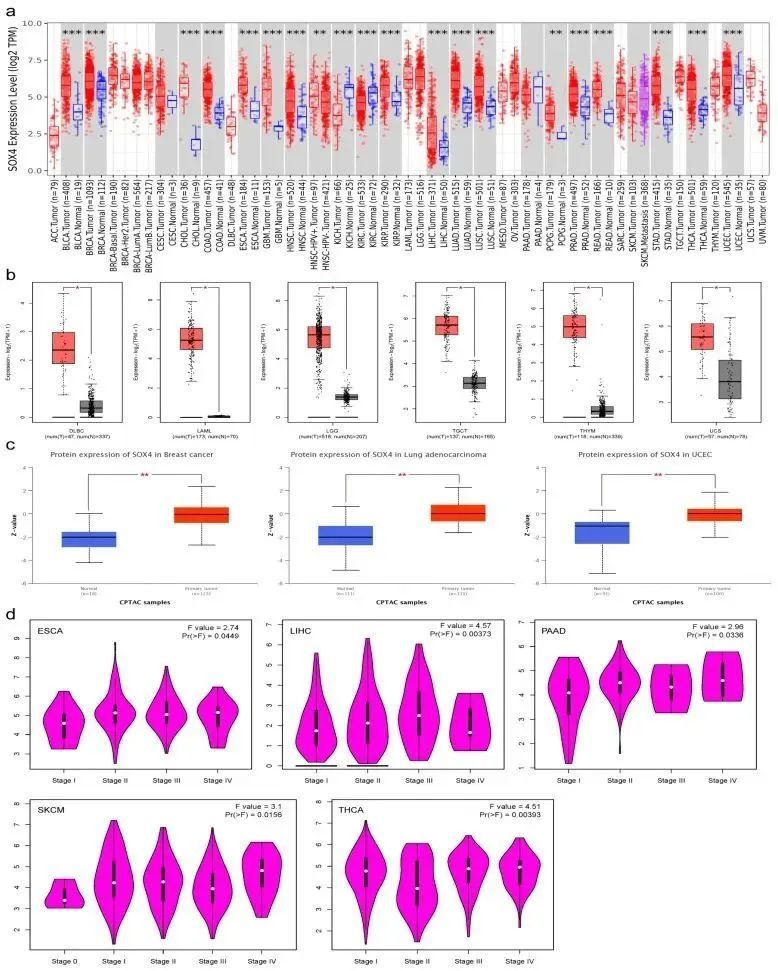
SOX4在不同肿瘤类型中的预后价值
作者研究了SOX4在患者中的预后价值。根据GEPIA2分析结果,高SOX4表达与LGG和LIHC的不良生存率显著相关,低SOX4表达与KIRC和THYM的不良生存率显著相关(图2a)。此外,高SOX4表达与ESCA和PAAD的不良无病生存率显著相关,低SOX4表达与UCEC的不良无病生存率显著相关(图2b)。根据Kaplan-Meier分析结果,高SOX4表达与LIHC、胰腺导管腺癌和SARC的不良生存率显著相关。然而,低SOX4表达与HNSC、卵巢癌和THYM的不良生存率显著相关。对于无病生存率,高SOX4表达与宫颈鳞状细胞癌、食管腺癌、LIHC、肺腺癌、胰腺导管腺癌和THCA的不良无病生存率显著相关。然而,低SOX4表达与卵巢癌和PCPG的不良无病生存率显著相关。如图2c,d所示,基于Kaplan-Meier Plotter,SOX4表达与21种肿瘤类型患者的OS和DFS的相关性在森林图中展示。
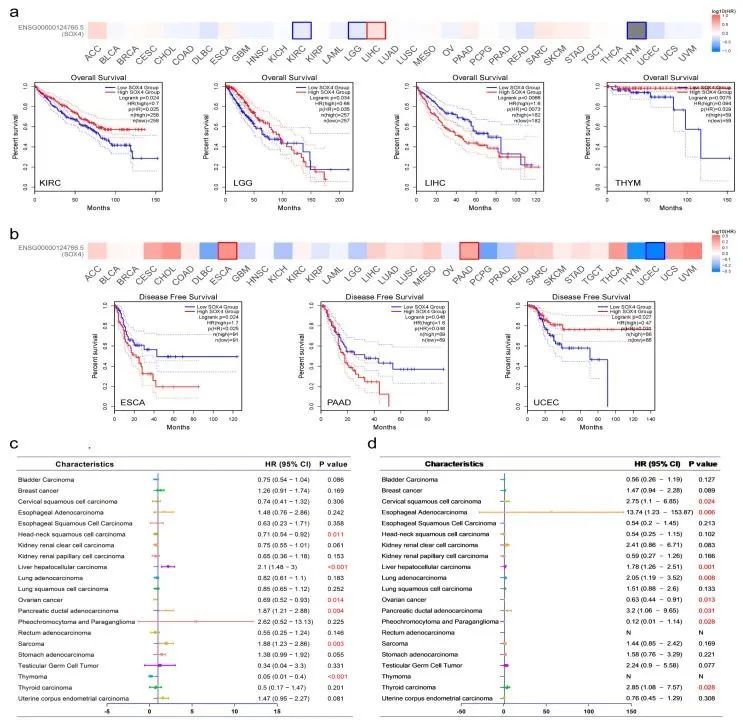
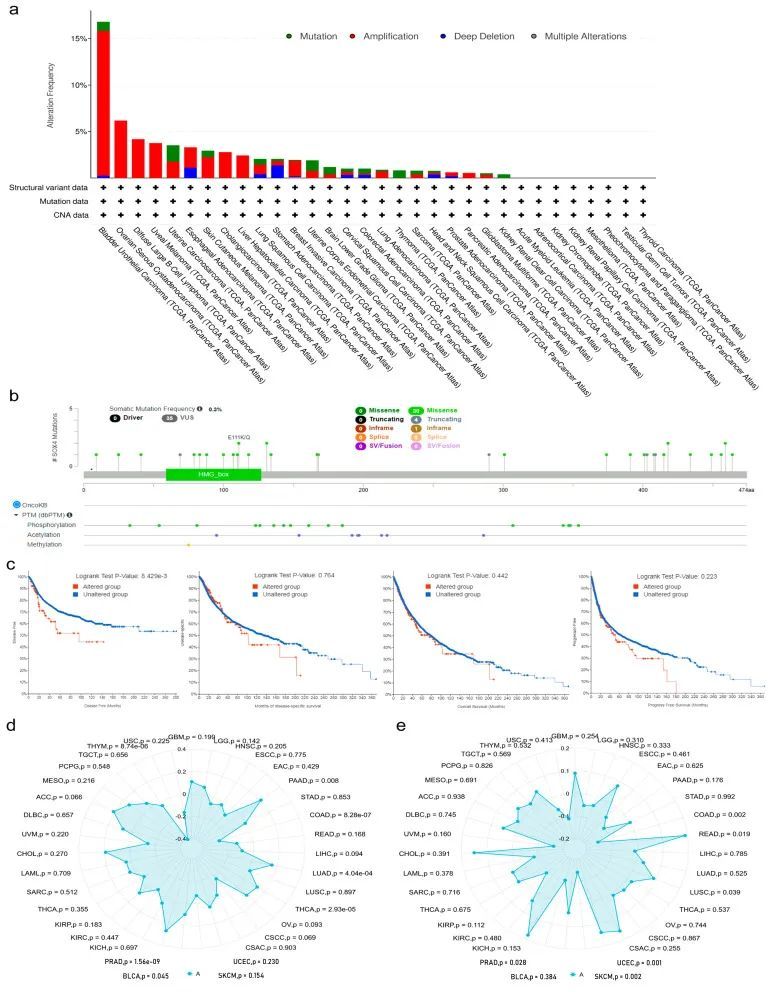
SOX4在不同肿瘤类型中的基因突变
遗传突变是导致肿瘤发生和预后的主要问题。为了阐明SOX4突变在肿瘤中的潜在作用,作者使用cBioPortal数据库中的TCGA数据,检查了32种人类肿瘤中SOX4基因的突变频率。如图3a所示,32个分析的肿瘤中有24个有一个以上的突变,8个肿瘤没有突变,包括LAML、ACC、KICH、KIRP、MESO、PCPG、TGCT和THCA。BLCA患者的SOX4基因突变频率最高(16.79%),其次是OV(6.16%)。在所有类型的遗传突变中,“扩增”类型是最常见的变化。值得注意的是,在CHOL、DLBC、LIHC、OV、PAAD和UVM患者中,SOX4基因的唯一变化类型是“扩增”类型。此外,在KIRC和THYM患者中,SOX4基因的唯一变化类型是“突变”类型。图3b展示了SOX4突变(包括错义、截断和内框)的类型、位点和案例数。体细胞突变的频率为0.3%。在0到474个氨基酸之间有35个突变位点。错义是主要的遗传突变类型。如图3c所示,与未经任何SOX4基因改变的样本(即未改变组,病例数=5277)相比,至少有一个SOX4基因改变的样本(即改变组,病例数=106)在DFS方面显示出较差的预后,但在PFS、OS和DSS方面没有显示出差异。SOX4基因的突变计数与拷贝数改变基因组的比例呈正相关(Spearman = 0.34,Pearson = 0.21)。同时,作者研究了SOX4表达与TMB和MSI的相关性。结果表明,在BLCA、LUAD、PAAD、PRAD和THCA患者中,SOX4的异常表达与TMB呈正相关,但与COAD和THYM呈负相关(图3d)。SOX4的异常表达与LUSC、READ和UCEC患者的MSI呈正相关,但与COAD、PRAD和SKCM呈负相关(图3e)。
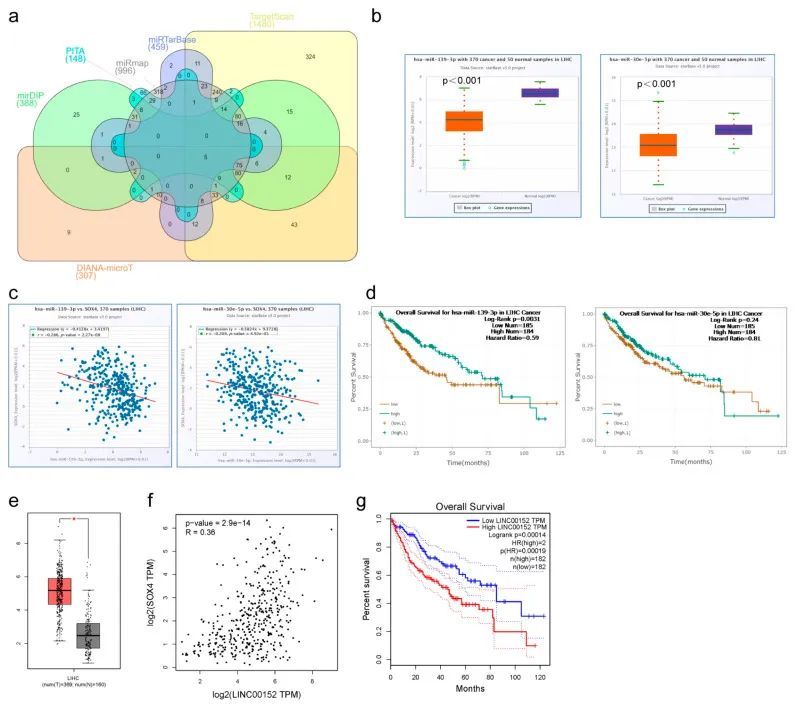
SOX4在LIHC中的ceRNA调控网络
越来越多的证据表明,lncRNA的变化和功能障碍会导致基因异常表达,并促进多种癌症的形成、进展和转移。lncRNA可以吸收miRNA,然后促进mRNA的表达。为了探索SOX4与lncrna和miRNA之间的关系,作者因此分析了LIHC肿瘤组织中SOX4的ceRNA调控网络。作者首先使用DIANA、PITA、TargetScan、miRTarBase、miRmap和mirDIP等六个目标预测数据库预测了SOX4的潜在miRNA。如Venn图(图4a)所示,至少在六个目标预测数据库中有215个交集miRNA被鉴定出来。在这些miRNA中,只有两个miRNA(hsa-miR-139-3p和hsa-miR-30e-5p)的表达显著低于相邻正常组织,并且与LIHC中SOX4的表达呈负相关(图4b、c)。此外,hsa-miR-139-3p的表达与LIHC的不良生存率显著相关。然而,hsa-miR-30e-5p的表达与LIHC的生存率之间没有统计学显著差异(图4d)。因此,作者进一步关注了hsa-miR-139-3p在肝细胞肝癌中的作用,并预测了其上游lncRNA。在LncBase Predicted v.2数据库中鉴定出了476个lncRNA。在这些lncRNA中,只有LINC00152的表达显著高于相邻正常组织,并且与肝细胞肝癌中SOX4的表达呈正相关(图4e,f)。此外,LINC00152的表达与肝细胞肝癌的不良生存率相关(图4g)。LINC00152的表达还与肝细胞肝癌中hsa-miR-139-3p的表达呈负相关。到目前为止,作者发现LINC00152可以作为一个ceRNA通过吸附hsa-miR-139-3p来调节SOX4的表达。
SOX4在LIHC中的免疫特性
肿瘤免疫微环境(TIME)参与肿瘤克隆进化、生长、转移、预后、药物抗性以及治疗结果。因此,作者进一步分析了SOX4在肝细胞癌(LIHC)中的免疫特征。首先,作者评估了SOX4表达与免疫细胞浸润水平之间的关系。使用聚类热图可视化了SOX4表达与各种肿瘤类型中的免疫浸润细胞(包括CD8+ T细胞、CD4+ T细胞、B细胞、中性粒细胞、巨噬细胞和髓样树突状细胞)之间的相关性。特别是在LIHC中,结果显示SOX4表达与TIMER中的肿瘤纯度显著相关。值得注意的是,SOX4表达与CD4+ T细胞、B细胞、中性粒细胞、巨噬细胞和髓样树突状细胞呈正相关,但与CD8+ T细胞无关(图5a)。对于巨噬细胞极化分析,SOX4表达与M0极化呈正相关,但与M1或M2极化无关(图5b)。其次,作者分析了SOX4表达与CD8+ T细胞、B细胞、中性粒细胞、巨噬细胞、髓样树突状细胞、肿瘤相关巨噬细胞、单核细胞和自然杀伤细胞以及Tfh、Th1、Th2、Th9、Th17、Th22、Treg和疲劳T细胞标记物之间的关系。通过聚类热图可视化了SOX4表达与上述细胞标记物在不同肿瘤类型中的相关性。特别是在肝细胞癌中,SOX4的表达与CD19、CD38、CD8A、CD8B、CXCR5、ICOS、BCL6、CCR3、GATA3、TGFBR2、IRF4、IL21R、IL23R、STAT3、CCR10、AHR、CCR8、CTLA4、CD68、CD80、CD86、XCL1、CD7、MPO和CD1C呈正相关,与ARG1和CD14呈负相关。
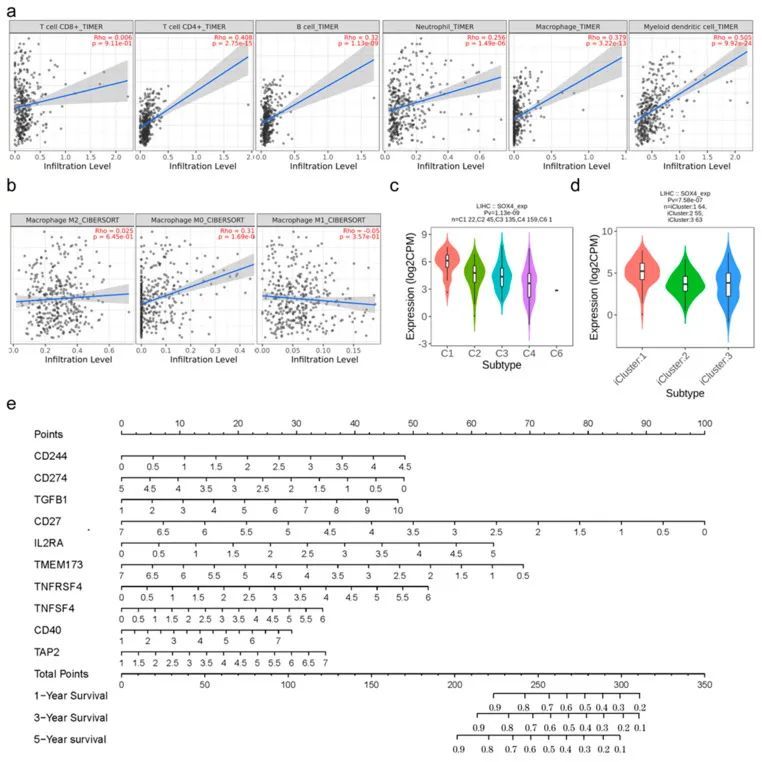
基于SOX4相关基因的肝细胞癌预后模型
作者进一步建立了六个基于SOX4相关基因的多基因预后模型,分别用于预测肝细胞癌(LIHC)的预后。这些基因最初是通过全面的文献搜索收集而来的。基于SOX4相关的DNA损伤修复相关基因的预后模型收集了200个基因,并使用聚类热图可视化它们在不同肿瘤类型中与SOX4表达的相关性。在LIHC中,LASSO分析发现有21个基因在回归系数中不为零。多元逻辑回归分析表明RFC3、RAD54B、MUTYH、MGMT、HAP和UVSSA是OS的独立风险因素。这些基因被用于构建诊断图(图6a),其中风险评分=(-0.1752)×RFC3 +(1.4157)×RAD54B +(0.3664)×MUTYH +(-0.3797)×MGMT +(0.406)×HAP1 +(-0.3656)×UVSSA。

在Lenvatinib治疗的LIHC细胞中,SOX4沉默的作用
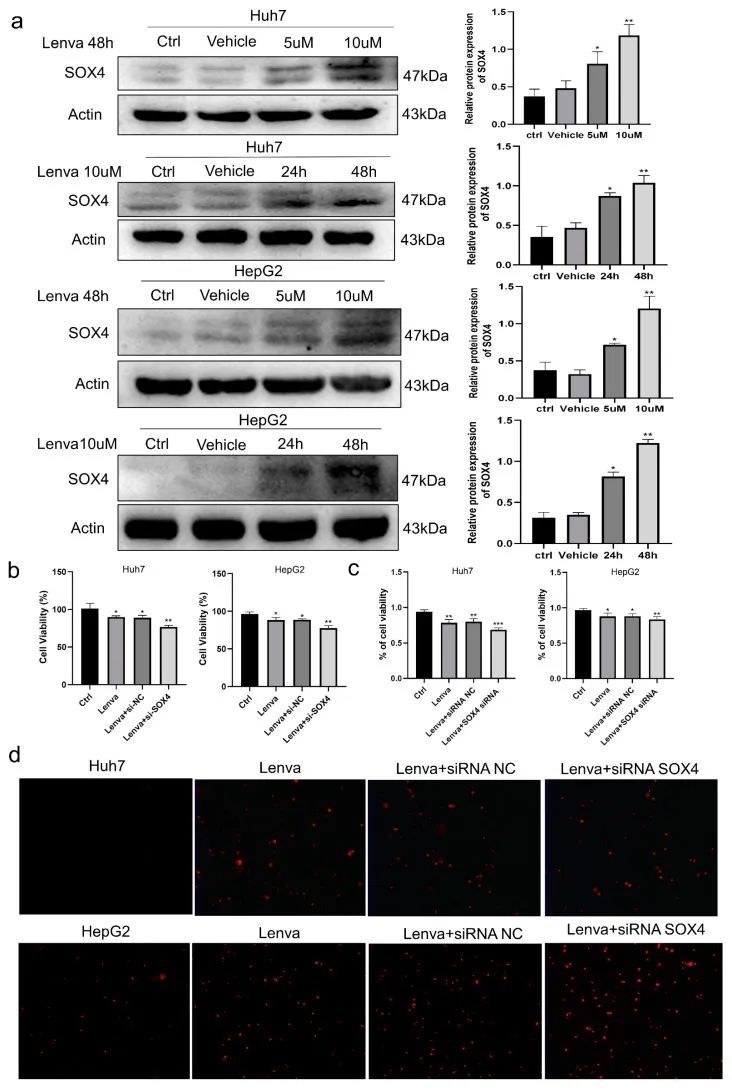
为了进一步验证SOX4在上述全癌分析和LIHC中的结果,作者在体外分析了SOX4沉默对lenvatinib处理的LIHC细胞的作用。众所周知,lenvatinib已被批准作为一线药物用于治疗不能手术切除的肝细胞癌[13]。首先,Huh7和HepG2细胞分别用0、5或10 uM lenvatinib处理24或48小时。结果显示,lenvatinib以时间和剂量依赖的方式增加了HepG2和Huh7细胞中SOX4的表达(图7a)。为了进一步探索SOX4表达与lenvatinib耐药性之间的关系,作者在LIHC细胞中沉默了SOX4。用lenvatinib(10 uM)处理的HepG2或Huh7细胞经过SOX4 siRNA处理48小时,分析细胞增殖和坏死。CCK8试验和尝试蓝染色显示,与lenvatinib处理组相比,lenvatinib联合SOX4沉默显著抑制了HepG2和Huh7细胞的增殖和存活能力(图7b、c)。细胞凋亡和坏死实验也显示,与单独使用雷伐替尼治疗相比,联合雷伐替尼和SOX4沉默显著增加了HepG2和Huh7细胞的坏死(图7d)。
总结
总之,SOX4在肿瘤组织中广泛过表达,并与不利的预后、遗传突变和DNA甲基化水平相关,尤其在肝细胞癌中。此外,结果提供了支持LINC00152/hsa-miR-139-3p/SOX4作为肝细胞癌治疗的关键靶点的新证据。结果还揭示了SOX4表达在肝细胞癌中免疫细胞浸润、巨噬细胞极化、免疫亚型、分子亚型和免疫调节剂以及与时间相关的预后中的重要作用。此外,该研究基于与SOX4相关的基因建立了六个有利的预后模型,用于预测肝细胞癌的预后,包括DNA损伤修复相关基因、EMT相关基因、M6A甲基化相关基因、缺氧相关基因、能量代谢相关基因和铁死亡相关基因。最后,作者发现SOX4在体外对来那替尼的耐药中起着重要作用。总的来说,这项研究强调了SOX4在肿瘤诊断和预后中的关键作用,尤其在肝细胞癌中,并作为肿瘤治疗的有希望的治疗靶点。
本文来自互联网用户投稿,该文观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。 如若内容造成侵权/违法违规/事实不符,请联系我的编程经验分享网邮箱:chenni525@qq.com进行投诉反馈,一经查实,立即删除!