7+坏死性凋亡+分型+预后模型+实验,筛坏死性凋亡相关基因并建模
今天给同学们分享一篇生信文章“MLKL and other necroptosis-related genes promote the tumor immune cell infiltration, guiding for the administration of immunotherapy in bladder urothelial carcinoma”,这篇文章发表在Apoptosis期刊上,影响因子为7.2。

结果解读:
67个坏死性凋亡的遗传特征和转录变异
该研究分析了先前研究中与坏死程序性细胞死亡相关的67种分子。进行了坏死性凋亡相关基因的全癌症分析,并评估了18种癌症类型中坏死性凋亡分子的mRNA表达水平。该分析基于从TCGA数据库获取的肿瘤和正常样本之间的表达水平比较。结果显示,与18种癌症类型的正常样本相比,CDKN2A和PLK1在肿瘤样本中显著过表达。相反,KLF9在正常样本中显著过表达。在KIRC(肾透明细胞癌)、KIRP(乳头状肾细胞癌)和BLCA(膀胱尿路上皮癌)中,肿瘤样本中MLKL和CASP8的表达水平高于正常组织(图S2A、S3B、表S1)。此外,研究发现PLK1的高表达与包括KIRC、KIRP等在内的11种肿瘤类型的预后不良相关,而KLF9的高表达与KIRC的良好预后相关(图S3E)。该研究还在TCGA数据库中对33种癌症类型中的67个坏死性凋亡相关分子的表达进行了相关性分析。结果显示,在所有33种癌症类型中,MLKL与CASP8、ZBP1、FASLG、RIPK1和RIPK3呈强正相关,而RIPK3与CASP8、MLKL和ZBP1也呈强相关(图S2C)。此外,与大多数其他坏死性凋亡基因相比,包括TNFRSF1A、TNFRSF1B、TNFSF10和TNFRSF21在内的TNF相关基因的平均表达水平在全癌症中较高(图S3A)。
图S2B展示了TCGA全癌症数据库中32种癌症类型的3907个样本中,67个与坏死性凋亡相关的分子的遗传变异情况。通过瀑布图展示了10个最常发生突变的坏死性凋亡分子。在3907个病例中,2679个样本(68.57%)存在坏死性凋亡突变。最高频率的突变出现在BRAF基因(19%),其次是ATRX基因(15%)、IDH1基因(13%)、CDKN2A基因(10%)和EGFR基因(9%),其中错义突变是最常见的类型。BRAF、ATRX、IDH1、CDKN2A和EGFR的最高突变频率分别出现在黑色素瘤(SKCM)、甲状腺癌(THCA)、低级别脑胶质瘤(LGG)、头颈部鳞状细胞癌(HNSC)和胶质母细胞瘤(GBM)中(图S2B、S4C)。作者对肿瘤和正常组织中的DNA甲基化进行了分析,发现KLF9和GATA3在肿瘤组织中显著高于正常组织[Lung squamous cell carcinoma (LUSC)、Lung adenocarcinoma (LUAD)、Colon adenocarcinoma (COAD)等]。相反,与正常组织相比(KIRC BLCA LUSC LUAD等),肿瘤组织中的MLKL和CASP8显著降低(图S2D)。KLF9的高甲基化与多种癌症类型(如LGG、胸腺瘤(THYM)和子宫癌肉瘤(UCS))的较低生存率相关,但在KIRC中,KLF9的高甲基化与更好的预后相关(图S3F)。基因甲基化与基因表达之间的spearman相关分析结果显示,在33种癌症类型中,大多数坏死性凋亡相关基因的基因甲基化与基因表达呈负相关。有趣的是,ALK和BCL2的甲基化水平与大多数癌症类型中ALK和BCL2的mRNA表达水平呈正相关,以及APP的甲基化水平与肝细胞癌(LIHC)中APP的mRNA表达水平之间的正相关,以及CD40的甲基化水平与食管癌(ESCA)中CD40的mRNA表达水平之间的正相关(图S2E)。作者的研究结果证实,拷贝数变异(CNV)是影响坏死性凋亡相关分子表达的重要因素。在33种癌症类型中,拷贝数变异(CNV)的突变率和mRNA的表达水平在大多数与死亡相关的基因中呈正相关,尤其是在FADD和USP22的情况下。相反,在RIPK3和FASLG的情况下,CNV突变率和表达水平之间在THYM和胰腺腺癌(PAAD)中呈负相关(图S2F)。与死亡相关的基因中的杂合性CNV突变在大多数肿瘤类型中更为普遍(图S3C,S3D)。
在这项研究中,作者分析了坏死性凋亡亚型之间的基因表达差异,并研究了相关信号通路的特征。作者的研究结果显示,包括PLK1、MLKL、FASLG和ZBP1在内的许多重要的坏死性凋亡分子在全癌中表现出高水平的激活,这些分子在凋亡信号通路中发挥重要作用。同时,PLK1、DNMT1、TARDBP和HAT1在细胞周期中表现出高水平的激活。另一方面,TNFRSF21、TNFRSF1A、STAT3、RIPK1、KLF9、EGFR和AXL在细胞周期和DNA损伤应答中均表现出高水平的抑制。此外,MLKL和RIPK3在膀胱尿路上皮癌中不仅在抑制细胞周期信号通路和DNA损伤修复信号通路方面发挥作用,而且只有MLKL能够促进凋亡信号通路。在前列腺腺癌(PRAD)中,MLKL和RIPK3通过激活激素ER和EMT信号通路。在作者的研究中,作者对膀胱尿路上皮癌中的坏死性凋亡死亡给予了重要的关注。在膀胱尿路上皮癌的412个样本中,TSC1和CDKN2A在TCGA数据库中的突变频率最高,分别为8%和6%(图S2H)。作者的结果显示CDKN2A和STAT3、CDKN2A和TNFRSF21、CDKN2A和RNF31、ZBP1和BRAF、FASLG和PLK1以及FASLG和PANX1在BUC中存在显著的共突变(P < 0.05)。这些发现表明BUC的发生与均衡调节的坏死性凋亡相关基因密切相关。
12个与预后相关的坏死性凋亡基因与免疫、肿瘤干细胞特性的关系特征
接下来,作者对BUC中的67个与坏死性凋亡相关的基因进行了单变量Cox回归分析,并确定了12个与预后相关的基因(P < 0.05,图1A,S5)。这12个基因在33种癌症类型中发挥着不同的作用(图1B)。作者对这12个与坏死性凋亡相关的基因与全癌症中不同免疫亚型之间的相关性进行了分析,结果显示基因表达在亚型之间存在显著差异。FASLG、MLKL和HAT1基因在IFN-γ优势型(C2)和TGF-beta优势型(C6)亚型中表达最高,而在免疫静默型(C5)亚型中表达最低。相反,EGFR、APP和TNFRSF21基因在C5亚型中表达最高(图1C,表S12.1)。在BUC中,与其他免疫亚型(包括伤口愈合型(C1)、炎症型(C3)和淋巴细胞减少型(C4)亚型)相比,FASLG、MLKL、HAT1、MYC、PANX1和EGFR基因的表达水平在C2亚型中显著较高(图1D,表S12.2)。MYC和SLC39A7基因的表达在I期较IV期较低,而IMPK基因的表达在I期较IV期较高(图1E,表S12.3)。作者对12个预后坏死性凋亡基因在全癌症中进行了EstimateScore分析,发现FASLG和MLKL与33种癌症类型中的基质得分和免疫得分强烈正相关,而ID1、GATA3和TNFRSF21与BUC中的基质得分和免疫得分呈负相关(图1F、G、J)。评估基因表达与肿瘤干细胞得分之间的相关性,以确定坏死性凋亡基因与肿瘤分化程度之间的关联。肿瘤干细胞得分是通过RNA基因表达评估的RNA干细胞指数和通过DNA甲基化评估的DNA干细胞指数计算得出的。在淋巴瘤弥漫大B细胞淋巴瘤(DLBC)、GBM、KICH和LUSC等癌症中,RNAss和DNAss中的干细胞得分与FASLG和MLKL的表达呈负相关(图1H、I)。有趣的是,作者发现BUC中MLKL和APP的表达与免疫细胞浸润呈正相关,但与肿瘤干细胞性质呈负相关(图1J)。作者的研究结果表明,12个坏死性凋亡基因,尤其是MLKL,在肿瘤免疫细胞浸润和肿瘤细胞干性方面起着至关重要的作用。
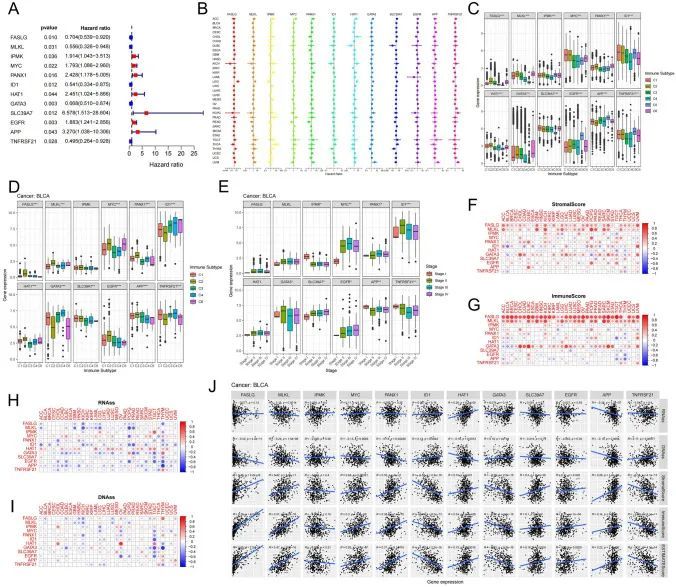
在1841个BUC样本的队列中,通过无监督聚类分析鉴定出了两种不同的坏死性凋亡模式
构建染色体环图和网络图以直观显示与12个与预后相关的坏死性凋亡基因的染色体位置和表达之间的相互依赖关系。在TCGA数据库中,与其他10个基因不同,HAT1和PANX1的拷贝数变异(CNV)损失较大,而不是增益(图2A)。在TCGA数据库中,肿瘤组织中HAT1和SLC39A7的表达水平高于相邻正常组织,而MYC的表达水平低于相邻正常组织(图S6A)。与其他七个坏死性凋亡相关基因相比,MLKL、FASLG、ID1、GATA3和TNFRSF21是BUC患者良好预后的关键因素(图2B,S5)。然而,与大多数12个坏死性凋亡基因的表达呈正相关不同,GATA3与FASLG、APP、MLKL、MYC和PANX1呈负相关,同样,ID1与FASLG和APP呈负相关(图2B)。

两个坏死性凋亡中的信号通路、单核苷酸变异和拷贝数变异的差异
为了确定分子特征,作者首先对两组之间的基因表达进行了差异分析。基因集富集分析的结果显示,与代谢相关的基因集,如“脂肪酸降解过程”和“单羧酸降解过程”,主要富集在A亚型中,而与免疫相关的基因集,如“粒细胞趋化”、“髓系白细胞迁移”和“中性粒细胞迁移”,主要富集在B亚型中(图3A)。这个结果与KEGG基因集变异分析(GSVA)的发现一致,GSVA也显示与代谢相关的基因集主要富集在A亚型中,而B亚型不仅富集了与免疫细胞相关的信号通路,还富集了细胞因子相关的信号通路(图3B)。此外,标志基因集富集分析(GSEA)显示B亚型富集了与凋亡和缺氧相关的基因集,以及与细胞因子相关的信号通路,如“IL2_STAT5_SIGNALING”、“IL6_JAK_STAT3_SIGNALING”(图3C)。作者进一步收集了BUC的关键分子特征基因集,并通过GSEA鉴定出了两个分子特征的亚群。作者的发现与先前的分析结果一致,表明在A亚型中,腺样分化的富集比例显著较高,而在B亚型中,基底分化和免疫细胞分化的富集比例显著较高(图3D)。这表明A亚型主要以腺样分化和肿瘤代谢为特征,而B亚型主要与免疫细胞浸润和基质分化相关。
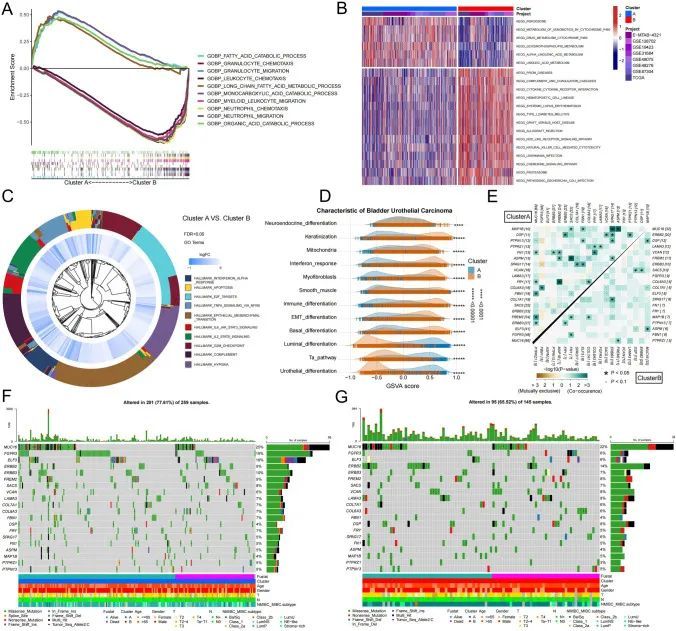
肿瘤免疫微环境中的免疫浸润和检查点特征在坏死凋亡表型中
作者对两个坏死性凋亡的免疫细胞浸润和免疫检查点特征进行了详细调查,因为它们展示了不同的免疫模式。作者使用了七种不同的评分方法,包括ssGSEA、MCPimmunescore、Timer、Epic、CIBERSORT、Quantiseq和Xcellimmunescore,基于基因表达特征,作者使用R语言分析了1841个BUC样本中的免疫细胞浸润水平。此外,作者使用“estimate” R软件包评估了样本的免疫得分和基质得分,并使用T细胞功能障碍和排斥(TIDE)来预测免疫治疗反应(表S6)。作者的结果显示,在所有七种免疫细胞评分方法中,BUC中巨噬细胞浸润水平在B亚型中明显高于A亚型。具体而言,肿瘤相关巨噬细胞M2的浸润水平在B亚型中显著较高(图4A)。肿瘤免疫微环境中还显示出B亚型中髓系抑制细胞(MDSCs)、髓系树突状细胞和单核细胞的高浓度(图S9A4)。此外,在B亚型中观察到大量的T细胞积累,包括CD4+和CD8+ T细胞,导致较高的免疫评分和基质评分,尽管肿瘤纯度较低(图S9B)。B亚型中T细胞功能受损和排斥的较高评分表明T细胞免疫功能严重受损(图S9A)。总之,尽管B亚型有更高的T细胞浸润,但由于存在大量的肿瘤免疫抑制细胞,如MDSCs、癌相关成纤维细胞(CAFs)和巨噬细胞,其T细胞功能严重受损。这可能导致B亚型患者的总体生存率较低(图4A)。为了进一步了解坏死性凋亡对肿瘤微环境的影响,作者分析了肿瘤免疫细胞与坏死性凋亡基因之间的相关性。作者的研究结果显示,FASLG和MLKL与大多数免疫细胞之间存在正相关,而GATA3 ID1和TNFRSF21之间存在负相关(图4B,S10B-C)。除了一些互相之间呈负相关的免疫浸润细胞,比如CD4+ T细胞和CD8+ T细胞之间,大多数肿瘤免疫细胞表现出相互促进的特点(图4C,S9C)。
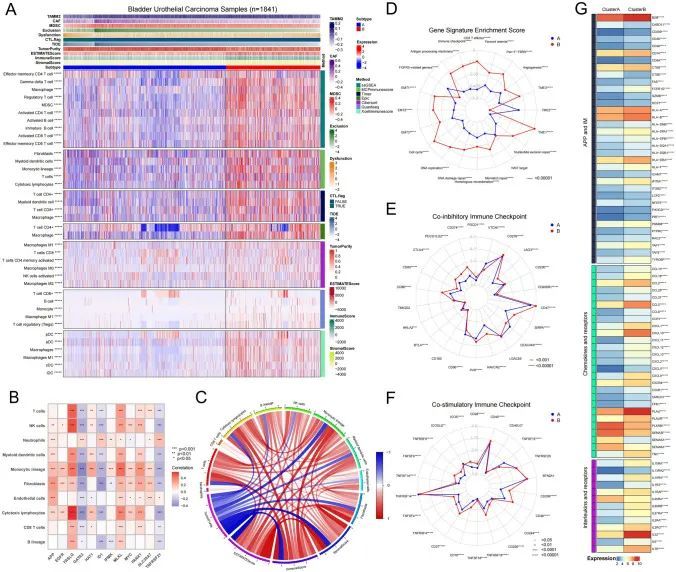
在膀胱组织中验证坏死性凋亡基因的表达
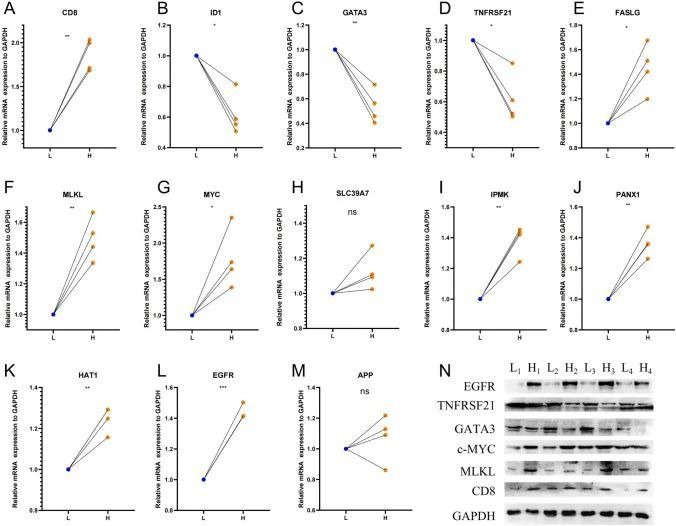
最初,作者检测了8个样本中12个与预后有关的坏死性凋亡相关基因和CD8的mRNA表达情况(表S14)。根据CD8 mRNA的表达水平,作者将样本分为两组:高组和低组,以中位数作为分割点。为了研究CD8与其他12个基因之间的关系,作者随机将高CD8组样本与低CD8组样本配对,共得到四对进行比较。作者的研究结果如图5所示,表明CD8表达高的BUC组织中,FASLG、MLKL、MYC、IPMK、PANX1、HAT1和EGFR等基因的表达水平较高,而ID1、GATA3和TNFRSF21等基因的表达水平较低,与CD8表达低的组织相比。此外,作者还通过蛋白质表达水平验证了EGFR、MLKL、TNFRSF21、GATA3、MYC和CD8之间的关系,结果与上述发现一致(图5)。遗憾的是,作者没有发现CD8的表达与临床病理指标之间存在显著关系(表S15)。这些基因的表达与CD8的表达之间的相关性与坏死性凋亡基因的表达与CD8+ T细胞浸润水平之间的相关性一致。
BUC中关键的坏死性凋亡基因RIPK3和MLKL的免疫特性
作者使用肿瘤免疫估计资源(TIMER)数据库分析了坏死性凋亡关键基因RIPK3和MLKL的拷贝数变异(CNVs)与各种免疫细胞的免疫浸润水平之间的关联。结果显示,MLKL的染色体水平缺失与B细胞和CD4+ T细胞的浸润水平呈正相关(图S11A)。此外,RIPK3的染色体水平缺失与CD8+ T细胞、CD4+ T细胞、中性粒细胞和树突状细胞的浸润水平密切相关。相反,RIPK3的染色体水平增益与B细胞、CD4+ T细胞、中性粒细胞和树突状细胞的免疫浸润水平相关(图S11B)。
接下来,作者使用TIMER数据库评估了全癌症中坏死性凋亡相关蛋白激酶3(RIPK3)和坏死相关蛋白激酶结构域样蛋白(MLKL)的拷贝数变异与不同免疫细胞浸润水平之间的关系。作者的研究结果显示,在大多数癌症类型中,MLKL与PD1、PD-L1、PD-L2和CTLA4等免疫检查点的表达呈正相关,除了在膀胱尿路上皮癌(BUC)中与ICOSLG、CD200、CEACAM1、HHLA2和VTCN1无关。此外,MLKL的表达与大多数癌症类型中所有免疫细胞浸润水平呈正相关(图S11C,表S8.1和图S11D,表S8.2)。另一方面,RIPK3的表达与大多数免疫检查点呈正相关,仅在肾透明细胞癌(KIRC)、肾乳头状癌(KIRP)、前列腺癌(PRAD)、肉瘤(SARC)、黑色素瘤(SKCM)和甲状腺滤泡状癌(TCGT)等九种癌症类型中存在相关性。然而,在膀胱尿路上皮癌(BUC)中,RIPK3的表达与PD1、PD-L1、PD-L2和CTLA4等重要的免疫共抑制检查点无显著相关性(图S11E,表S8.3)。RIPK3的表达与肾上腺皮质癌(ACC)和胶质母细胞瘤(GBM)等癌症中的免疫细胞浸润水平呈正相关,但在膀胱尿路上皮癌(BUC)中,其与免疫细胞浸润水平的相关性不强(图S11F,表S8.4)。总之,作者的研究结果显示,MLKL促进了各种免疫细胞的浸润和免疫检查点的共表达,尤其是在膀胱尿路上皮癌中。而RIPK3的拷贝数变异类型对免疫细胞浸润水平有显著影响。
NecroScore的临床和免疫特征
为了预测BUC患者的预后和免疫治疗效果,作者创建了一个名为NecroScore的PCA模型,该模型使用了两个坏死程序模块之间的差异基因,这些基因显示出显著的生存差异和免疫相关性。作者根据基因表达数据(表S10)将NecroScore评分公式应用于1841个BUC样本。作者的分析结果显示,B族群的NecroScore显著高于A族群(图6A)。在构成坏死程序模块的12个坏死基因中,有11个基因与NecroScore强相关(图S12A)。基因PANX1、MYC、FASLG和MLKL与NecroScore呈正相关,而ID1、TNFRSF21和GATA3呈负相关。基因SCL39A7与NecroScore没有显著相关性。此外,作者对NecroScore与BUC的临床分子分型之间的关系进行了调查,结果显示随着NecroScore的增加,BUC的分子分型趋向于从非肌肉相关分子分型和腺管分子分型转变为基底分子分型(图S12B,表S13.4)。BUC样本的整体生存率在TCGA和GEO数据集中,高和低NecroScore得分的差异显著,并且在EMTAB数据集中,进展生存率也有显著差异(图6B、C、S14A)。
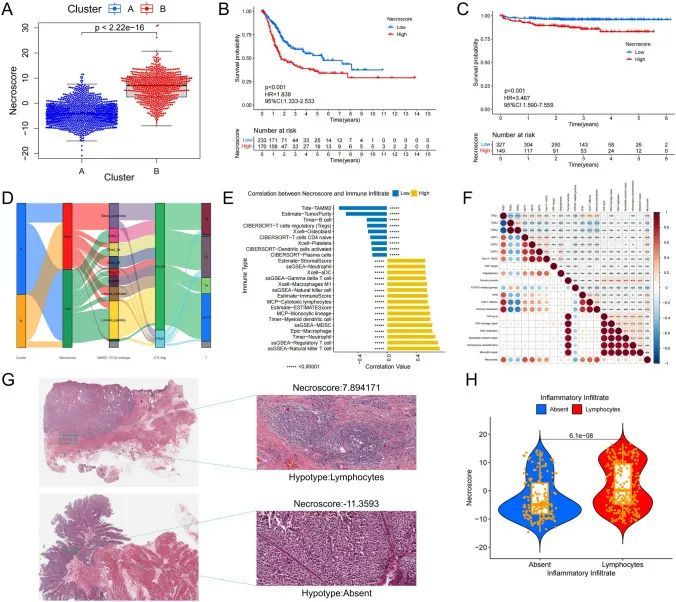
通过NecroScore预测BUC患者的预后
根据作者的分析结果,作者发现高和低NecroScore组的BUC患者预后显著不同。为了确定NecroScore对BUC患者预后的影响,作者进行了多元Cox回归分析。分析中考虑了五个因素,包括年龄、性别、分级、TMB和NecroScore。其中,年龄、分级、TMB和NecroScore对BUC患者的生存率有显著影响(图7A)。观察到TMB与BUC患者的生存率呈正相关,而NecroScore和分期则不然(图S14B)。为了进一步了解NecroScore和TMB的影响,作者根据这两个因素将TCGA BUC数据集分为四组,并发现在这些组之间的生存率存在显著差异,低NecroScore高TMB组的生存率最高,高NecroScore低TMB组的生存率最低(图7B)。为了预测BUC患者的预后,作者开发了一个综合评估模型,考虑了年龄、分期、TMB和NecroScore(图7C)。该模型在预测1年和3年生存率方面有效,但在预测5年生存率方面准确性较低[图7D]。该模型通过ROC曲线进行验证,显示AUC值随着生存时间的增加而增加。然而,使用单一指标,如分期或TMB,对于预测BUC患者的预后不被认为足够可靠。为了评估模型的预测准确性,作者使用C指数,并发现评估模型是可靠的(图7E,S14C-H)。
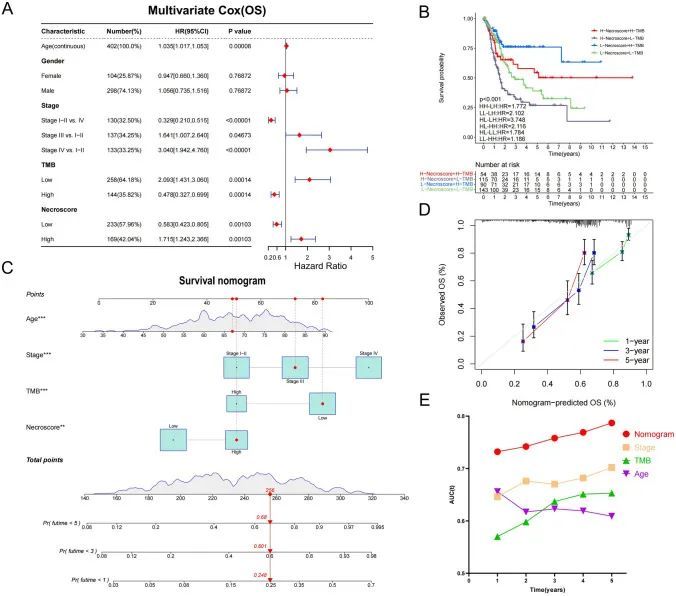
NecroScore预测BUC患者对抗肿瘤治疗的敏感性
根据公共药物基因组学数据库中的药物反应数据,癌症药物敏感性基因组学(GDSC)和治疗反应门户网站(CTRP),作者分析了与BUC临床治疗疗效相关的坏死样细胞死亡相关分子之间的关系。基因组药物抗性分析数据来自GDSC/CTRP IC50药物数据,利用Spearman相关方法分析基因表达与药物疗效之间的相关性。负相关表示高基因表达使患者对药物更敏感,而正相关则表示相反。作者的结果表明,大多数基因对这些药物具有高抗性,但EGFR、TNFRSF21和ID1对ERBB治疗药物(包括拉帕替尼、吉非替尼、厄洛替尼、西妥昔单抗和阿法替尼)显示出显著的协同效应。此外,作者观察到多个基因对17-AAG(一种Hsp90抑制剂)、曲美替尼(一种MEK抑制剂)和多西他赛(一种紫杉醇类抗肿瘤药物)等药物具有协同效应。高MLKL表达的患者对17-AAG、Trametinib、RDEA119(Refametinib,MEK抑制剂)和CI-1040(MEK抑制剂)非常敏感(图S15A)。令人惊讶的是,CTRP数据库中几乎所有抗肿瘤药物都对高MYC表达的患者非常敏感(图S15B)。为了更全面地了解坏死相关分子与抗肿瘤药物敏感性之间的关系,作者使用CellMiner数据库分析了各种癌细胞系中基因表达与药物敏感性之间的相关性。正相关意味着药物对较高基因表达更敏感。结果显示,几种药物对坏死相关基因具有协同作用,包括AMG-900(泛Aurora激酶抑制剂)、BLU-667(Pralsetinib,RET抑制剂)、BOS-172722(MPS1抑制剂)、CH5132799(PI3K抑制剂)、Dexrazoxane(心脏保护剂)、IDH-C227(IDH1抑制剂)、Irofulven(DNA烷基化剂)、P529(Palomid 529,mTORC1和mTORC2复合物抑制剂)和PQR530(PI3K/mTORC1/2双抑制剂)等。发现药物如AMG900、BOS-172722和Dexrazoxane对几种与坏死相关的分子,包括MLKL(图S15C,表S11),具有很强的敏感性。
坏死相关分子在化疗中的重要性促使作者评估NecroScore在预测膀胱尿路上皮癌患者化疗结果方面的准确性。作者研究了高和低NecroScore组之间的基因表达差异,包括化疗、免疫疗法、ERBB疗法、FGFR疗法和抗血管生成疗法等常见药物靶点。结果显示,除了Afatinib(ERBB2,ERBB4)、Trastuzumab(ERBB2)、Lapatinib(ERBB2)、Infigratinib(FGFR2,FGFR3)和Sorafenib(BRAF,RAF1)之外,大多数常见药物靶点在高NecroScore组中高度表达(图S16A)。为了进一步验证化疗药物在膀胱尿路上皮癌患者中的治疗效果,作者利用GDSC数据库和“pRRophetic” R软件包来预测高和低NecroScore患者对常见化疗药物的反应。结果显示,高NecroScore组中顺铂、多柔比星、吉西他滨和其他化疗药物的IC50值较低,表明高NecroScore患者对这些药物可能更敏感(图S16B-I)。
NecroScore预测BUC患者的免疫疗法反应
作者对IMvigor210队列中的患者进行了NecroScore分析,并将其分为高NecroScore组和低NecroScore组。结果显示,高NecroScore组的患者在抗PD-L1治疗后的预后较低NecroScore组更好(图8A,S17A,B)。作者的分析揭示了NecroScore与抗PD-L1治疗的有效性之间存在显著相关性,高NecroScore组中完全缓解(CR)的比例较低NecroScore组更高(图8B,C)。有趣的是,作者发现随着NecroScore的增加,IMvigor210队列中免疫细胞和肿瘤细胞中阳性细胞(PD-L1表达≥1%)的比例也增加,尤其是在TC2+(TC≥5%)和IC2+(IC≥5%)比例中,高NecroScore组明显高于低NecroScore组(图8D,E,S17C,D)。此外,高NecroScore组中PD1和PD-L1的表达水平明显高于低NecroScore组(图S17F,G)。BUC患者在高NecroScore组的免疫表型更倾向于炎症表型,而低NecroScore组更倾向于沙漠表型(图8F,S17E)。作者对IMvigor210队列中基因拷贝数改变与NecroScore之间的关系进行评估,结果显示FGFR3的短变异体(<49个碱基对)在NecroScore较低的患者中更为普遍,而TP53的短变异体则相反。细胞周期相关基因CDKN2A和CDKN2B的缺失是主要的突变形式(图8G)。
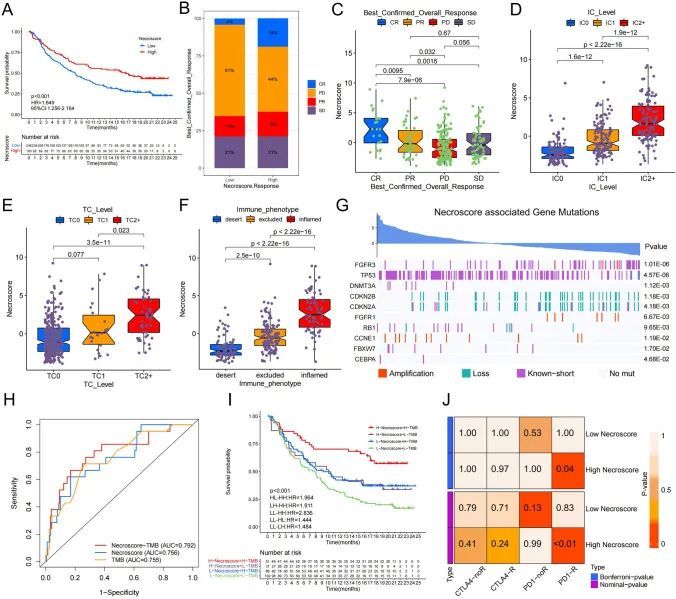
RIPK3和MLKL可以调节体内肿瘤生长速率和肿瘤免疫细胞浸润程度
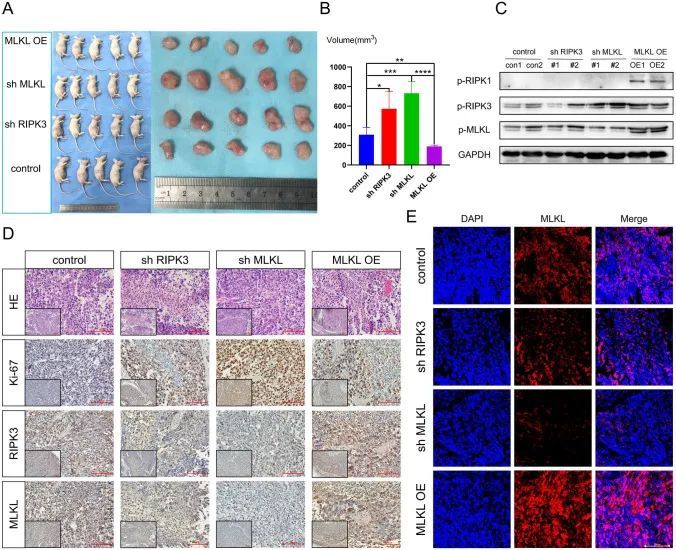
作者成功地在裸鼠中建立了一个皮下BUC模型,使用对照组、shRIPK3、shMLKL和过表达MLKL的T24细胞。与普通T24细胞转染的裸鼠相比,RIPK3和MLKL敲除的皮下BUC肿瘤生长速度显著加快。另一方面,MLKL过表达的皮下BUC肿瘤生长速度则相反(图9A、B)。作者的结果显示,RIPK3和MLKL对应的磷酸化蛋白在敲除组中表达下降,而过表达组中磷酸化MLKL的表达增加(图9C-E)。此外,过表达MLKL的皮下BUC肿瘤的增殖能力显著降低,而敲除RIPK3和MLKL的肿瘤增殖能力改善(图9D)。MLKL过表达的皮下肿瘤组织显示大量中性粒细胞浸润,而敲除MLKL的皮下肿瘤组织几乎没有中性粒细胞浸润。这与先前的研究结果一致,即MLKL的RNA表达越高,中性粒细胞浸润越多(图9D、S11D)。
总结
总之,诱导坏死程序性细胞死亡的SMAC模拟剂与免疫检查点抑制剂的联合治疗对于具有高坏死程序模块的膀胱尿路上皮癌患者具有巨大潜力。值得注意的是,高坏死程序模块与FGFR3基因改变的比例显著较低(6%)相比,低坏死程序模块(19%)更低。作为评分工具,坏死评分与肿瘤免疫细胞的浸润水平(包括MDSCs、M2巨噬细胞和缺陷性毒性T淋巴细胞等)呈正相关。较高的坏死评分还与PD1和PD-L1等共抑制性免疫检查点的高表达密切相关。作为化疗药物敏感性和抗PD-L1治疗效果的预测指标,坏死评分可用于指导晚期和转移性膀胱尿路上皮癌患者的治疗方案,特别是PD-L1抑制剂与铂类化疗的联合应用。作者希望获得更多的临床数据来支持作者的研究结果,而NecroScore在未来可以在指导膀胱尿路上皮癌患者的化疗和免疫疗法中发挥重要作用。
本文来自互联网用户投稿,该文观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。 如若内容造成侵权/违法违规/事实不符,请联系我的编程经验分享网邮箱:chenni525@qq.com进行投诉反馈,一经查实,立即删除!
- Python教程
- 深入理解 MySQL 中的 HAVING 关键字和聚合函数
- Qt之QChar编码(1)
- MyBatis入门基础篇
- 用Python脚本实现FFmpeg批量转换
- B/S医院手术麻醉临床管理系统源码 手术申请、手术安排
- 最佳利用Mock提升测试效率的7个技巧!
- http首部
- SpringBoot找不到或无法加载主类
- CSDN年度征文|我与CSDN的一周年相遇,为往年画句号让新年胜旧年
- Java Web3J :使用web3j调用自己的智能合约,返回一个内部有数组的对象结构时出现NPE问题
- Vault实战(三)-Vault命令详解
- 第八章--- 创建对战列表与排行榜页面
- 事件监听的艺术:掌握`addEventListener`的魅力
- VScode跑通Remix.js官方的contact程序开发过程