Nat Med | 多组学神经病理学在儿科神经肿瘤学中提高了诊断准确性

导语
今天给同学们分享一篇实验文章“Multiomic neuropathology improves diagnostic accuracy in pediatric neuro-oncology”,这篇文章发表在Nat Med期刊上,影响因子为82.9。

结果解读:
患者招募和样本处理
在为期4年的时间内(2015年4月至2019年3月),共有1,204名患者提供了可用的甲醛固定、石蜡包埋(FFPE)肿瘤组织,其中排除了163名未满足纳入标准的患者(117例复发,23例回顾性登记,12例转移,11例成年人)(图1a)。患者是以基于人群的方式从德国、澳大利亚/新西兰(自2017年6月开始)和瑞士(自2017年7月开始)的65个中心招募的(图1b和附图1、2)。在59个肿瘤中,收到的组织要么不足(31例,2.6%),要么不适合进行DNA甲基化分析和/或NGS(分别为4.0%和1.4%)(图1a)。从FFPE切片到首次分子报告的中位时间为21天(附图3a、b)。在招募率较高的中心,从肿瘤手术到成功患者登记的时间线较短(附图3c)。
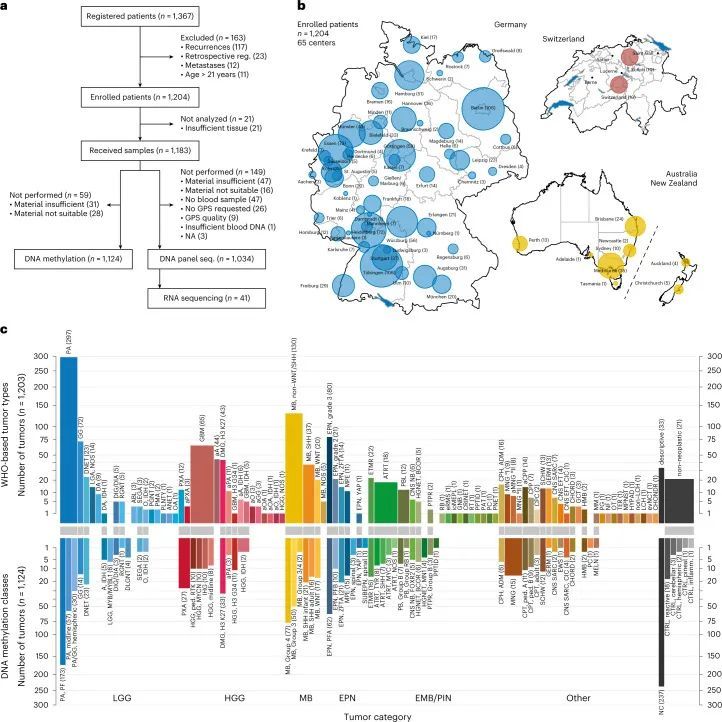
WHO基于神经病理学评估的中枢神经系统肿瘤类型
根据世界卫生组织对中枢神经系统肿瘤的分类,参考神经病理学评估对肿瘤类型的分布以及相应的临床患者数据,被认为代表了接受肿瘤活检或切除手术的儿童中枢神经系统肿瘤的基于人群的队列(图1c,扩展数据图1和2a,补充图2和补充表1)。与德国儿童肿瘤登记处的流行病学数据进行比较,显示每年有高达64%的新诊断中枢神经系统肿瘤的患者被纳入研究(补充图2b)。由于神经纤维瘤病1型相关或弥漫性中线胶质瘤通常不进行活检,可能导致这些类型的肿瘤在样本中被低估。在21个样本中未检测到肿瘤组织(1.7%)。在其余的1,182个肿瘤中,有1,028个病例(87.0%)被确定为确诊,77个病例与某种肿瘤类型相符(6.5%),22个病例可疑为某种肿瘤类型(1.9%)。对于55个肿瘤建立了描述性诊断,其中33个(2.7%)无法归类为任何肿瘤类别。最常见的诊断类别是低级别胶质/神经胶质瘤(LGG)(37.7%)、髓母细胞瘤(MBs,16.0%)、高级别胶质瘤(HGGs,15.6%)、室管膜瘤(EPN)(10.6%)和其他胚胎性或松果体(EMB/PIN)瘤(6.2%)(附图2a)。其他各种较少见的肿瘤类型共占队列的9.5%。患者的年龄和性别分布符合预期(扩展数据图2a)。

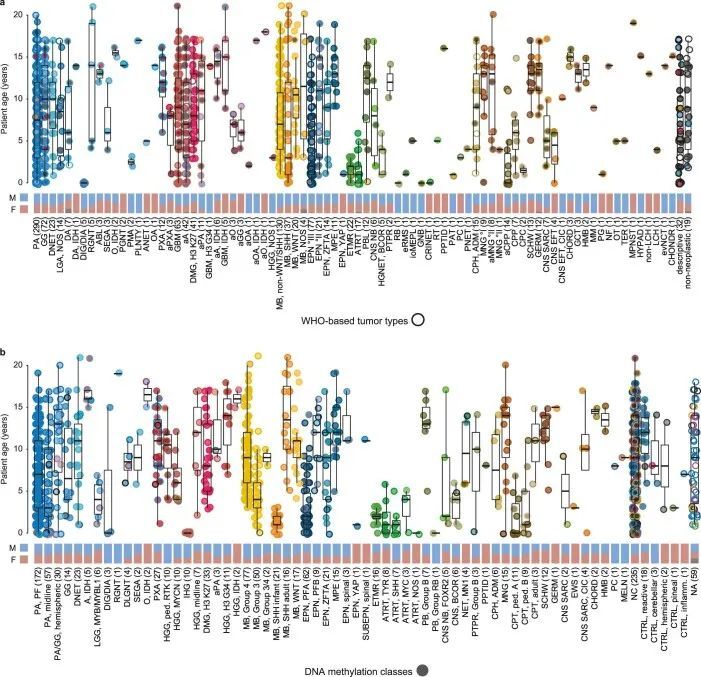
基于DNA甲基化的中枢神经系统肿瘤分类
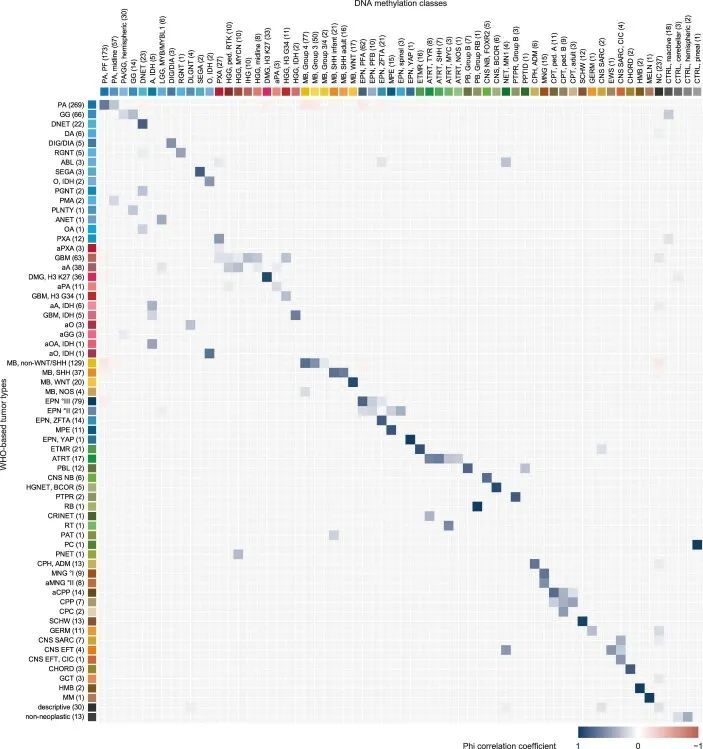
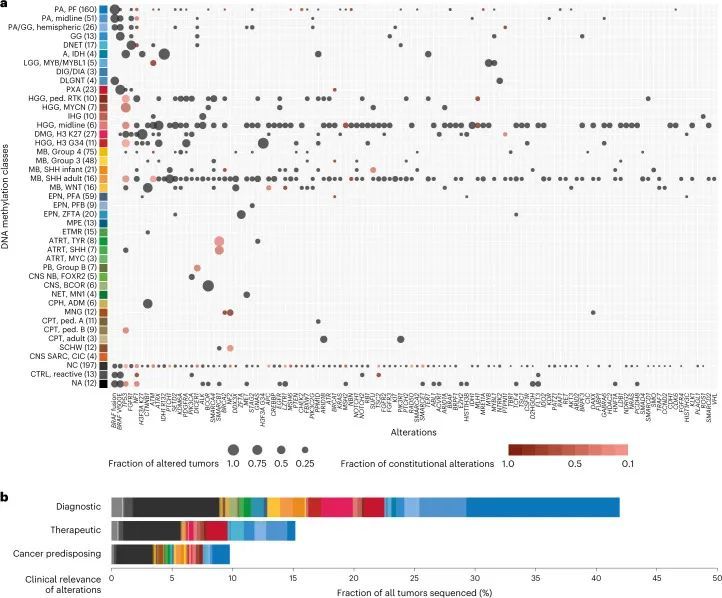
使用在诊断时最新适用的版本(版本9.0-版本11b4;方法(参考 4 ))的基于DNA甲基化的随机森林(RF)类别预测算法,肿瘤被分配到65个(可能有91个)不同的DNA甲基化类别中(图1c,扩展数据图1和附表1)。除了LGG(28.5%)外,MB(16.3%)是第二大类别,其次是HGG(10.1%)、EPN(10.1%)和其他EMB/PIN肿瘤(5.5%),而剩下的6.2%分布在其他较少见的类别中(图1c和附图2a)。相当大比例的肿瘤(21.1%)无法确定地分配到DNA甲基化类别中。DNA甲基化类别与患者年龄、性别和肿瘤位置的模式相关(扩展数据图2b和3),以及DNA拷贝数变异(扩展数据图4、附图4和5和附表2)。作为例子,DNA甲基化类别“婴儿半球胶质瘤”仅包括婴儿的半球肿瘤,这些肿瘤在细胞带2p23.2上频繁出现局部扩增,表明涉及ALK基因的融合(参考1);DNA甲基化类别“PXA”包括不同年龄段的半球肿瘤,这些肿瘤一直携带CDKN2A/B基因座(9p21.3)的纯合缺失;DNA甲基化类别“ETMR”主要包括年幼儿童的枕叶或后颅窝肿瘤,这些肿瘤在19q13.42处有一种特征性扩增(参考2)。其他重要的拷贝数变化包括“LGG, MYB/MYBL1”(6q24.1)中涉及MYB基因座的局部缺失,以及“HGG, MYCN”(2p24.3)中的MYCN扩增和“HGG, RTK”(7p11.2)中涉及EGFR的扩增(扩展数据图4)。
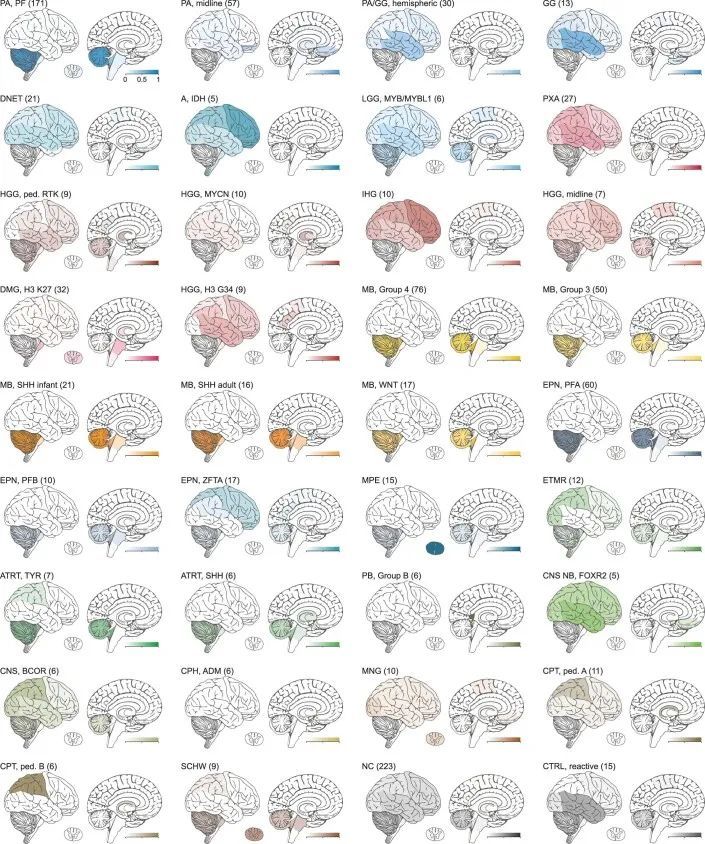
基于世界卫生组织(WHO)和DNA甲基化的分类比较
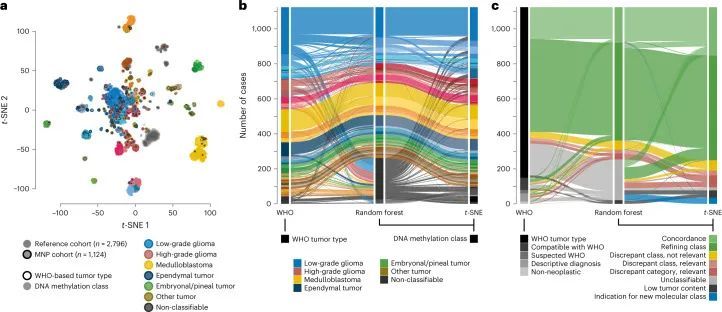
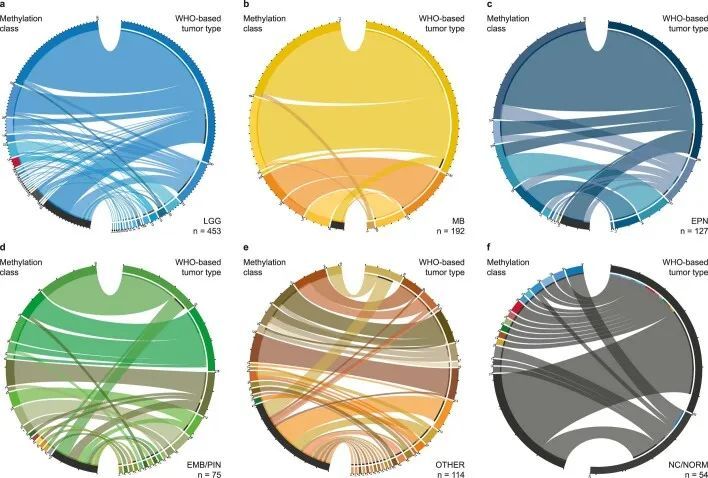
直接将基于WHO的肿瘤类型和DNA甲基化类别进行对比(图2,扩展数据图5,补充图6和补充表1),以及成对比较表明已知相互对应或交集的组合之间存在强相关性(扩展数据图6,补充图7和补充表3),但在基于RF预测的分类中,WHO定义的高级恶性肿瘤(33.5%),低级恶性肿瘤(20%)和其他罕见肿瘤(37.6%)中有很大比例的肿瘤无法分类(图2,扩展数据图5和补充表1)。通过t分布随机邻居嵌入(t-SNE)可视化DNA甲基化模式(图3a和补充表4),并通过视觉检查进行类别分配(补充图8a),可以对另外229个样本进行分类,其中34个肿瘤(3.0%)的特征表明其属于原始参考队列中未代表的新型分子类别,例如后颅窝的高级恶性肿瘤和带有PATZ1融合基因或PLAGL1融合基因的神经上皮肿瘤(图3b、c和补充图8c)。在大多数肿瘤中(67.8%),神经病理学基于WHO的肿瘤分类和DNA甲基化类别预测被认为是一致的,在49.7%的所有病例中通过DNA甲基化类别的进一步细化(图3c和补充表1)。在同一类别内分配到不一致的肿瘤类别(2.0%)或不一致的肿瘤类别(3.0%)被认为是临床相关的(即改变了推荐的治疗方案)在所有病例中占5%。其中包括43个组织学不确定或无法检测到肿瘤组织的样本中的15个,其中大多数(11/15)被DNA甲基化分析分类为低级别胶质或胶质神经元瘤(扩展数据图5f)。在组织学分类的HGG中,临床相关的不一致性增加(24/173,13.9%)与其他WHO定义的类别相比(P < 0.001)。其中,最常见的组合(21/24)包括被分配为低级别胶质瘤(包括PA,GG或MYB/MYBL改变的肿瘤)的III-IV级(WHO级别3-4)的间变性(毛细胞)星形细胞瘤或胶质母细胞瘤(图2和补充图6a)。在LGG中,临床相关的不一致性较少(2.2%),MB(1.1%),EPN(1.6%)和其他肿瘤类型(0.0%)。目前不被认为临床相关的不一致的肿瘤类型和类别分别占样本的4.6%,主要影响低级别胶质和胶神经元瘤(29/52)(扩展数据图5a和补充图6b)。有1.4%的样本无法归类为任何肿瘤类别,或者在神经病理评估和DNA甲基化分析中均未检测到肿瘤组织(扩展数据图5f和图3b,c)。
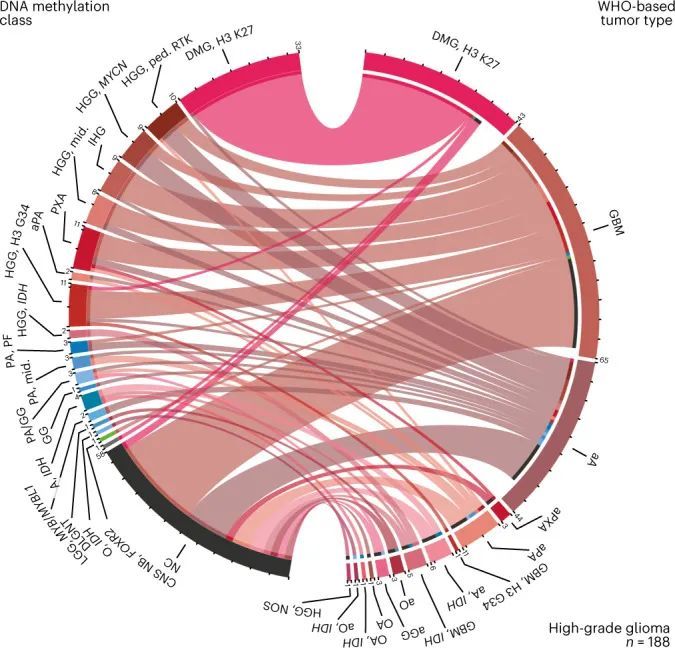
相关遗传改变的检测
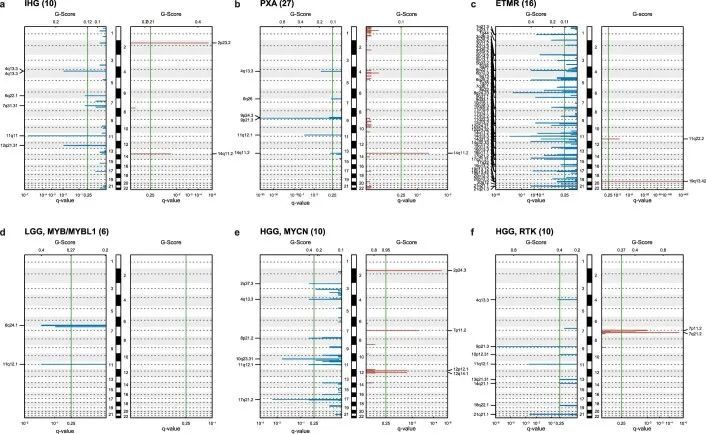
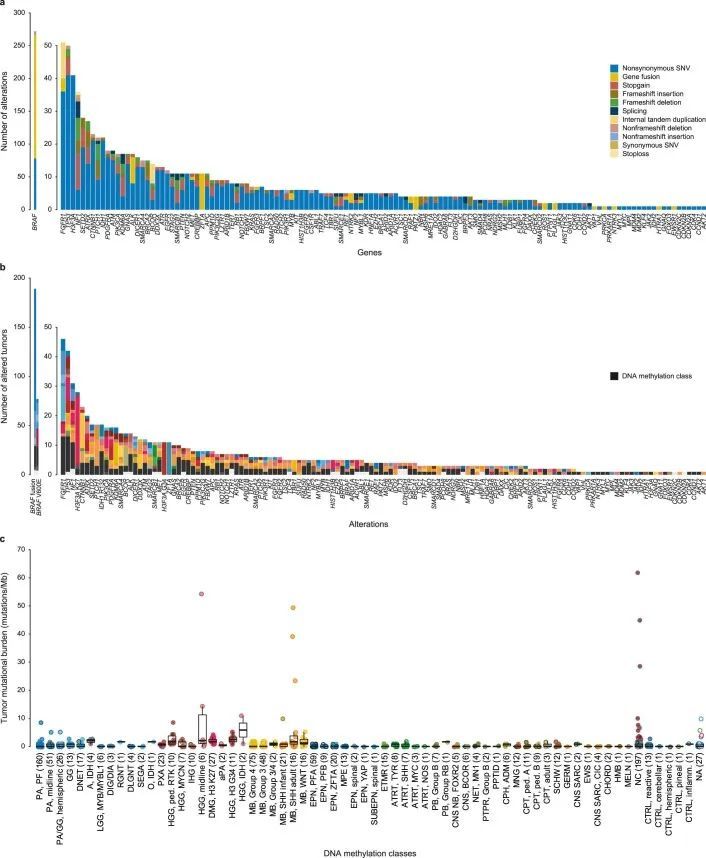
使用定制的富集/杂交捕获基于NGS的基因面板,包括130个感兴趣的基因(附表5),并在选定的案例中通过RNA测序进行补充,作者检测到1,034个肿瘤中625个(60.4%)的遗传变异(图4,扩展数据图7,附表6和附图9)。对于最常见的受影响基因BRAF(1,034个中的272个),在237个DNA甲基化定义的小脑下部(160个中的124个),中线(51个中的28个)或皮层LGG(26个中的6个)中观察到融合事件,而V600E突变进一步观察到在GG(13个中的7个)和PXA(23个中的17个)中。其他在所有肿瘤中突变率≥2%的基因包括TP53(5.1%),FGFR1(4.4%),NF1(4.2%),H3F3A(3.7%)和CTNNB1(2.2%)。在特定的DNA甲基化类别中,≥75%的肿瘤(有≥2个测序)中发生的经常性变异包括DMG中的组蛋白3 K27M,K27(27/27),HGG中的H3F3A G34R/V,G34(11/11),胶质瘤中的IDH1,IDH突变(7/7),CNS中的BCOR ITD,BCOR(6/6),ATRT中的SMARCB1,TYR(6/8),原发性颅内DICER1突变肉瘤中的DICER1(2/2),脊髓EPN中的NF2(2/2)和SEGA中的TSC1(2/2)。RF基于DNA甲基化类别预测,一部分肿瘤无法分类或被分配到对照类别,其中包含具有诊断指示性变异的BRAF(V600E,25/214;KIAA1549:BRAF,22/214)、IDH1(8/214)或H3F3A(K27M,2/214),以及不太明确的病理特征突变。总体而言,被认为具有诊断相关性的变异在肿瘤中检测到的比例为41.9%(BRAF,26.5%;H3F3A,3.9%;ATRX,2.1%;CTNNB1,1.8%;IDH1,1.6%;PTCH1,1.5%;ZFTA,1.1%;SMARCB1,1.1%;其他,<1%)。在15.2%的肿瘤中,被认为这些变异具有治疗意义,其中直接可靶向的变异包括BRAF(V600E,7.4%)、FGFR1/3(4.0%)、ALK(0.8%)、NTRK2/3(0.4%)、MET(0.1%)和RET(0.1%)(图4b)。被认为是高突变(每百万碱基对中≥10个体细胞突变)的肿瘤(11/1,034,1.1%)属于DNA甲基化类别MB、SHH(4/37)、HGG、中线型(2/6)、IDH(1/2)和无法分类(4/197)的肿瘤(扩展数据图7b),其中在三名患有高突变肿瘤的患者中检测到了与错配修复(MMR)相关基因的宪法致病性变异(见下文)。观察到在11名携带MMR相关基因宪法致病变异的患者中,有7名患者的肿瘤每兆碱基的突变负担超过5个。
癌症易感综合征的普遍性
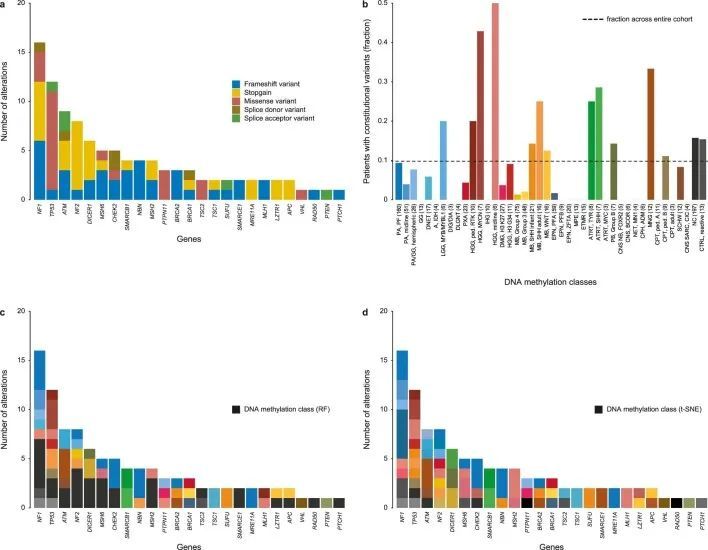
基因面板测序白细胞源DNA,能够筛查1,034名患者中被认为是(可能)致病的宪法变异(LPV/PV)。在1,034名个体中,检测到101个患有癌症易感性变异(9.8%)(图4b),涉及25个基因(图4a,扩展数据图8,补充图9和补充表6)。最常见的癌症易感性综合征(CPS)包括神经纤维瘤病1型(由NF1中的宪法LPV/PV引起;1.5%),Li-Fraumeni综合征(TP53;1.2%),宪法MMR缺陷或Lynch综合征(MLH1、MSH2和MSH6;1.1%;PMS2在分析时未包含在基因面板中),共济失调-毛细血管扩张和ATM杂合子携带者(ATM;0.9%),神经纤维瘤病2型(NF2;0.8%),DICER1综合征(DICER1;0.6%)和肾母细胞瘤易感综合征1型(SMARCB1;0.4%)。其他基因中的LPV/PV发生频率较低(<0.5%)。已知的相关性包括LGG中的NF1和非典型畸胎瘤/肉瘤中的SMARCB1(补充图9a,e)。附加的发现包括在MYCN激活的高级神经胶质瘤中富集的宪法性TP53变异体;在RTK激活和中线高级神经胶质瘤类别中的MLH1、MSH2和MSH6(扩展数据图8和补充图9b);以及一项显著的发现,即在一名H3 K27改变的DMG患者中发现了一种以前未知的PTPN11变异体。作者还观察到,有相当比例的患者存在致病性宪法性变异,但其肿瘤无法通过基于RF的DNA甲基化类别预测进行快速分类(31/101,30.7%),其中大多数显示高级(13/31,41.9%)或低级(4/31,12.9%)胶质瘤组织学,与基于t-SNE的DNA甲基化类别分配(15/31,48.4%)一致,包括三例IDH1突变星形细胞瘤。在作者检测到宪法性致病性变异体的101名患者中,只有37名(36.6%)在国家研究总部记录了癌症易感性的指标,这表明受影响个体及其家族中有高比例的以前未知的CPS。由于在常规的宪法患者DNA拷贝数评估中缺乏报道,因此在两名AT/RT患者和已知的恶性肿瘤易感综合征中,SMARCB1的宪法拷贝数变异没有被报道,其中的数据暗示了杂合性缺失。
跨学科肿瘤委员会讨论
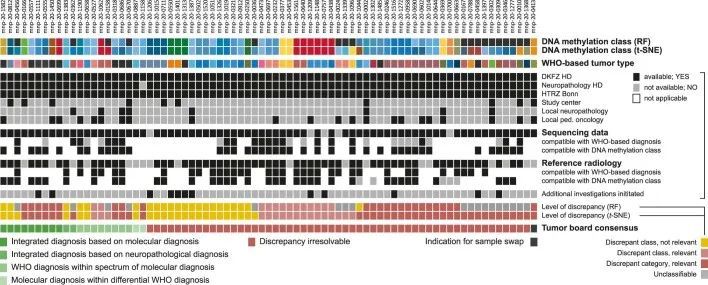
在每周的跨学科肿瘤委员会上讨论了神经病理学WHO分类和DNA甲基化分类不一致的病例(扩展数据图9和附表1)。在t-SNE检查后,重点关注DNA甲基化类别分配后的差异,70.1%的讨论差异被认为具有临床相关性。93.5%的病例提供了额外的基因组测序数据,76.6%的病例提供了参考神经放射学评估,并且在大多数病例中,这些数据与基于WHO分类(63%和100%)和DNA甲基化分类(100%和85%)都是一致的。NGS检测到的与WHO肿瘤类型不一致的变异主要发生在根据WHO标准定义的HGG中的BRAF或MYBL1改变(8/14)。15.6%的病例启动了其他调查(如靶向测序或FISH)。在27.3%的讨论病例中,通过综合诊断达成共识,其中42.9%基于DNA甲基化类别,9.5%基于WHO肿瘤类型;WHO肿瘤类型在DNA甲基化类别的组织病理谱范围内(38%)。1%);或者通过参考神经病理学评估将DNA甲基化类别视为鉴别诊断(9.5%)。在大多数讨论的案例中,仍存在无法解决的差异(71.4%)。对于WHO定义的DNA甲基化谱与低级别胶质瘤相似的间变性星形细胞瘤和胶质母细胞瘤的复查(在婴儿和幼儿中经常发生),显示出增加的有丝分裂活性,特别是异常(非典型)有丝分裂形态,是将其定为高级别的主要原因,而血栓形成的血管或排列坏死是个别案例中诊断为恶性的标准。在分子分析过程中发生了一个样本交换(<0.1%),在讨论中被发现。
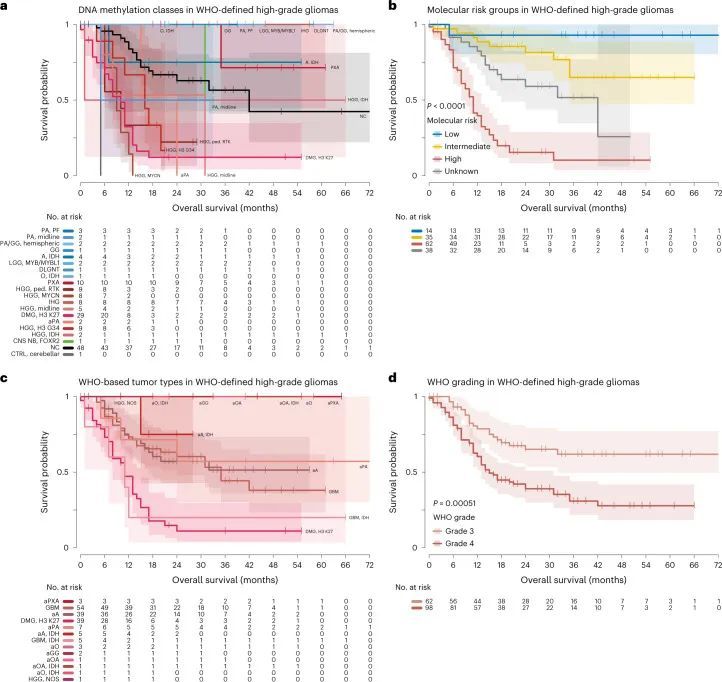
高级恶性脑胶质瘤患者的风险分层
根据世界卫生组织的标准,根据DNA甲基化谱的低级别胶质瘤的反复星座(图2),作者将世界卫生组织定义的高级别胶质瘤患者分为分子风险组。共有952名入组患者(79.1%)提供了有关生存和治疗方式的数据(附表1),其中包括162名世界卫生组织定义的高级别胶质瘤患者。诊断后的中位随访时间为22个月(范围为0-192个月)。高风险DNA甲基化类别(DMG,K27M;HGG,G34;HGG,中线;HGG,MYCN;HGG,RTK)的肿瘤与整体生存率(OS)较差相关,而中风险(A,IDH;HGG,IDH;aPA;PXA;IHG;CNS NB,FOXR2)和低风险(PA,PF;PA,中线;PA/GG,半球;GG;LGG,MYB/MYBL1;DLGNT)DNA甲基化类别的HGG与显著较长的OS相关(P < 0.001,log-rank检验)(图5a,b)。低风险组中包括四名完全缓解的儿童(其中两名在肿瘤切除后分别经过34个月和41个月的观察和等待策略),以及仅有五名接受过放疗和化疗的患者(附表1)。在使用DNA甲基化类别分配的t-SNE分析(附图10)或通过DNA甲基化类别定义HGG队列进行分析(附图11a,b)时,该组中获得了类似的结果。当比较被分配为WHO 3级和WHO 4级的肿瘤时,也存在显著但辨别力较低的差异(P = 0.0051)(图5c,d),而WHO 1-2级(PXA,13例中9例为WHO 2级)表明DNA甲基化定义的HGG在生存期方面有所改善(附图11c,d)。通过基于WHO的肿瘤类型和DNA甲基化类别进行的LGG(附图12),MB(附图13),EPN(附图14)和EMB/PIN(附图15)的额外生存分析显示了先前回顾性研究中已知的差异。
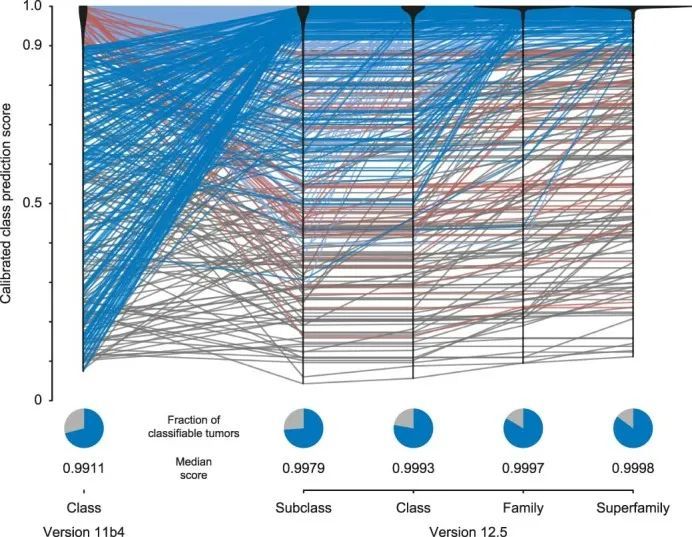
自动DNA甲基化类别预测的进展
为了评估基于RF的DNA甲基化类别预测的进展,作者将算法的11b4版本(于2017年10月公开发布)和12.5版本(于2022年1月发布)应用于1,124个肿瘤的DNA甲基化数据集(扩展数据图Fig.1010和补充表1)。通过增加总类别数,并引入DNA甲基化亚类(184个)、类别(147个)、类别家族(81个)和超家族(66个)的层次结构,无法轻易归类到任何肿瘤类别的肿瘤总数从11b4版本的29%减少到12.5版本的15%。与此同时,在11b4版本中被分配到一个明确类别的32个肿瘤(2.9%)在12.5版本中没有达到任何类别或家族的0.9阈值分数。另外,另外135个肿瘤(12.0%,其中126个经t-SNE分析被认为是可分类的)在RF算法的两个版本中仍然无法分类。在12.5版本中,167个无法分类的样本中,有58个样本通过NGS检测到与DNA甲基化类别相关的基因变异,包括BRAF(42/167)、IDH1(5/167)、组蛋白3基因(4/167)、CTNNB1(3/167)、ALK(2/167)、SMARCB1(1/167)和YAP1(1/167)。
总结
作者的研究结果表明,之前对中枢神经系统肿瘤发展中致病性体质变异的评估(约占患者的10%)似乎是相当可靠的,并且在H3野生型高级神经胶质瘤中富集了Li-Fraumeni综合征、Lynch综合征和体质性MMR缺陷。因此,作者建议对H3野生型高级神经胶质瘤的儿科患者进行遗传咨询和检测(除了现有的指南之外)。通过国家研究总部获取的临床信息显示,大多数患者并不知道或怀疑自己携带致病性体质变异,这与之前观察到的中枢神经系统肿瘤患者以外的患者类似。
本文来自互联网用户投稿,该文观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。 如若内容造成侵权/违法违规/事实不符,请联系我的编程经验分享网邮箱:chenni525@qq.com进行投诉反馈,一经查实,立即删除!