Nat Cancer | 白细胞介素17信号支持在黑色素瘤中的临床益处
今天给同学们分享一篇实验文章“Interleukin 17 signaling supports clinical benefit of dual CTLA-4 and PD-1 checkpoint inhibition in melanoma”,这篇文章发表在Nat Cancer期刊上,影响因子为22.7。

结果解读:
IL-17通路预测双重ICI的临床反应
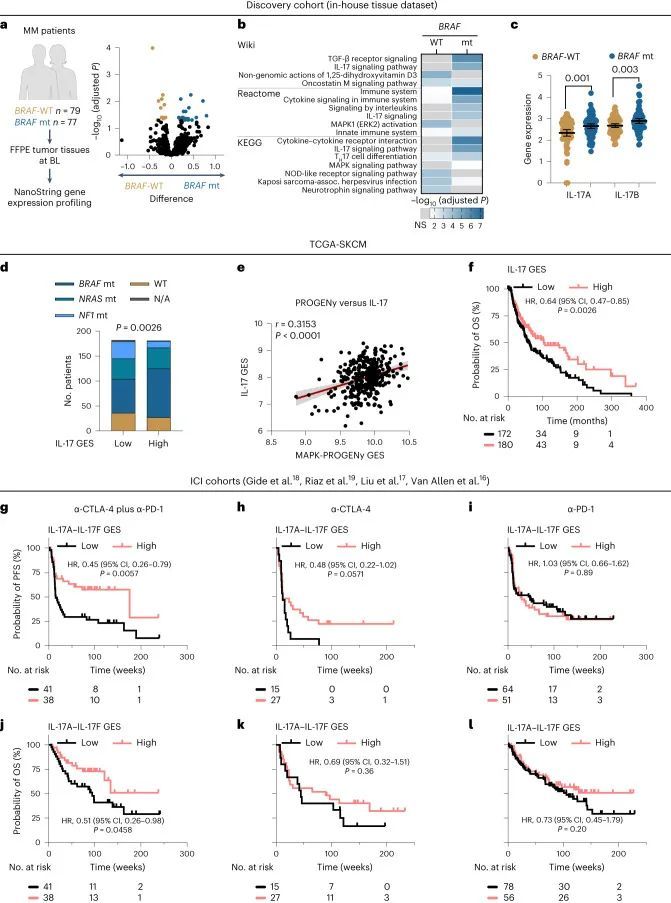
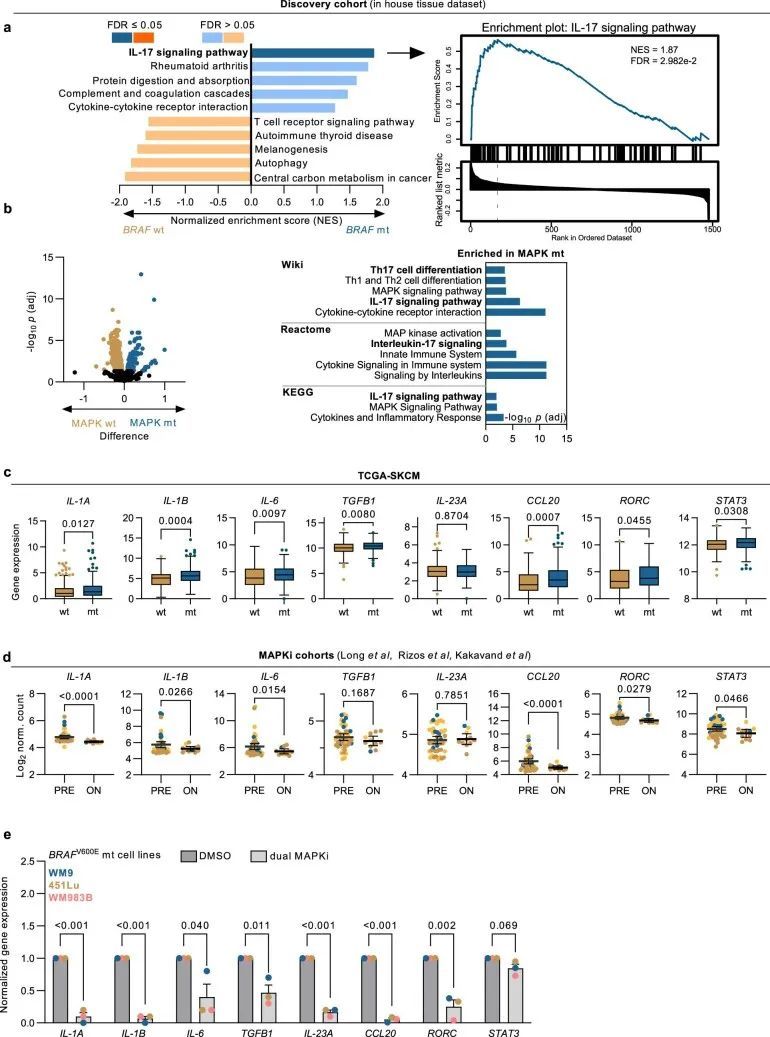
为了找到基于观察到的BRAF突变和BRAF-WT黑色素瘤对双重ICI治疗反应差异的ICI治疗预测的分子基础,作者对未经治疗的存档肿瘤样本进行了基因表达谱分析(发现组:n = 77个BRAF突变(V600热点阳性)黑色素瘤,n = 79个BRAF-WT黑色素瘤;图1a,左)。为了揭示与治疗相关的免疫和耐药途径中的基因表达谱,作者采用了NanoString技术,因为它具有分析稳定性,并能够优化检测福尔马林固定石蜡包埋材料中低表达的RNA靶标。发现组的基线临床特征和NanoString基因面板的详细信息已经最近描述过。差异基因表达分析揭示了BRAF突变和BRAF-WT肿瘤之间不同的转录景观。在BRAF突变肿瘤中有21个转录本显著上调,富集了细胞因子和趋化因子编码基因(图1a、b和附表1)。特别是,作者发现转录标记表明白细胞介素信号传导,尤其是IL-17,以及相关的T H 17细胞分化途径在基于通路富集和基因相关性分析的BRAF突变肿瘤中过度表达(图1b,c)。此外,基因集富集分析证实了BRAF突变肿瘤中IL-17 GES的上调(扩展数据图图1a)。
IL-17A对小鼠黑色素瘤双重ICI治疗的反应至关重要
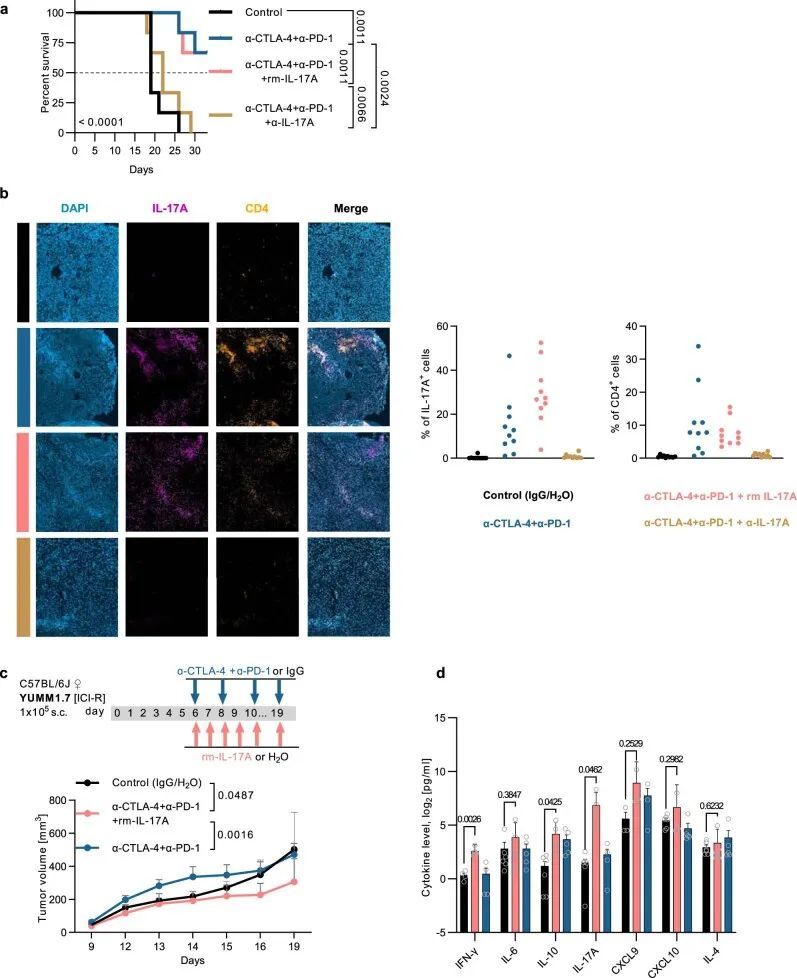
为了研究体内系统性IL-17A水平对ICI疗法的抗肿瘤疗效的影响,作者使用了两种同种移植黑色素瘤模型,其基因型和对实验性抗CTLA-4和抗PD-1抗体的反应特征不同。首先,作者检查了IL-17A中和抗体(α-IL-17A)和重组小鼠IL-17A(rm-IL-17A)对ICI敏感的MT/ret源原发性皮肤黑色素瘤(CM)小鼠模型(人类ret基因,BRAF-WT)肿瘤生长动力学的影响。如预期,与对照组相比,双重ICI显著减缓了CM肿瘤的生长(P = 0.0172)。与rm-IL-17A联合使用的双重ICI治疗也减少了肿瘤的生长(P = 0.0073与对照组相比),而添加α-IL-17A则强烈阻断了双重ICI的抗肿瘤效果(P = 0.0130与双重ICI相比;图2a),并显著缩短了生存时间(扩展数据图2a)。血清IL-17A水平的终点分析证实,添加α-IL-17A导致的血清IL-17A水平显著低于双重ICI治疗的小鼠(P = 0.0109;图2b)。此外,作者发现肿瘤大小与血清IL-17A水平之间存在负相关,特别是较大的侵袭性肿瘤(≥800 mm 3 )的IL-17A浓度显著较低(P = 0.0155;图 图2c2c)。

双重ICI中的IL-17相关细胞微环境
通过对不同的批量RNA-seq数据集进行体外分析,发现高IL-17表达与T H 17细胞、T细胞、树突状细胞、肥大细胞和中性粒细胞的高存在呈正相关(图(图3a))。值得注意的是,未经治疗的肿瘤(TCGA-SKCM数据)中已经存在与IL-17相关的T H 17细胞、树突状细胞和中性粒细胞的升高,这表明黑色素瘤的亚群可能具有预先存在的免疫组成,可能决定了对双重ICI前线治疗的易感性。
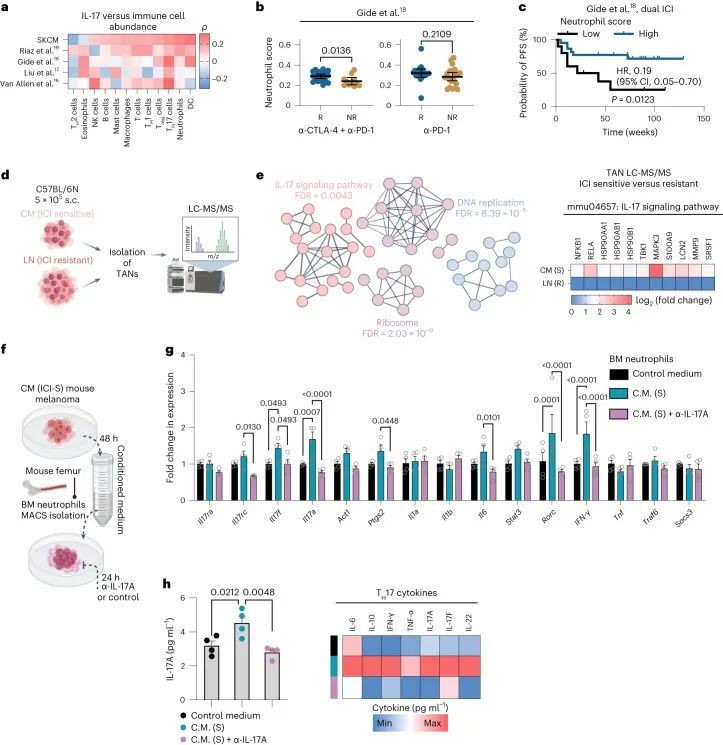
IL-17被认为通过诱导炎症细胞因子的表达和中性粒细胞的招募来激活先天免疫机制。因此,作者发现中性粒细胞基因特征在双重ICI治疗者的基线肿瘤中显著富集(P = 0.0136),但在单一抗PD-1治疗者中并未富集(P = 0.2109,Gide等人的数据集;图3b)。此外,基线时中性粒细胞丰度高与双重ICI队列中更长的无进展生存期相关(HR,0.19;95% CI,0.05-0.70;P = 0.0123)(图3c)。
为了实验验证中性粒细胞在免疫检查点抑制剂(ICI)应答中的作用,作者注射了C57BL/6N小鼠,其中一组注射了对ICI敏感的MT/ret CM细胞,另一组注射了对ICI抵抗的MT/ret LN亚系(来源于一个抵抗性淋巴结;扩展数据图3a),并将肿瘤扩大到约250 mm的大小。然后,作者从两个模型中分离出肿瘤相关的中性粒细胞(TANs),并进行液相色谱-质谱/质谱(LC-MS/MS)分析(图3d)。作者分析了ICI敏感和ICI抵抗TANs之间差异表达的蛋白质和富集的功能通路,并发现ICI敏感TANs中DNA复制、核糖体和IL-17信号通路相关蛋白质的表达显著增加(图3e)。接下来,作者从C57BL/6N小鼠中分离出未经刺激的骨髓(BM)中性粒细胞,并将其在来自ICI敏感CM黑色素瘤细胞的条件培养基中培养24小时,有或没有α-IL-17A(图3f)。作者确认,在与内在ICI敏感的小鼠黑色素瘤细胞培养基刺激下,几个IL-17信号通路基因在骨髓中性粒细胞中的表达水平明显增高,并且这种增高在同时进行α-IL-17A治疗后被消除(图3g)。相应的细胞培养上清液中,IL-17A和其他T H 17细胞因子水平也呈现类似结果(图3h)。
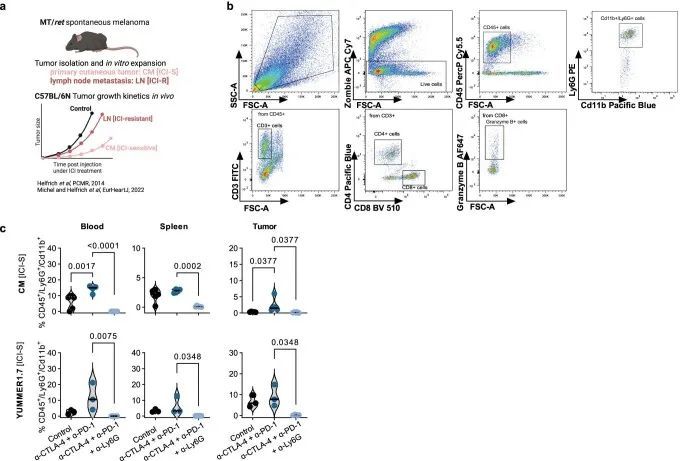
中性粒细胞在双重ICI中与IL-17相关的作用
接下来,作者应用了一种特异性耗尽中性粒细胞的抗Ly6G抗体,并将其与双重免疫检查点抑制剂联合应用于两个独立的易感移植模型(CM和YUMMER1.7)。为了避免骨髓中性粒细胞的再生和扩张,作者监测了短期肿瘤生长动力学。作者验证了抗Ly6G抗体对中性粒细胞的耗尽在两个模型中的技术有效性,通过观察第9天和第12天(分别是CM和YUMMER1.7模型)采集的血液、脾脏和肿瘤样本中CD45、CD11b和Ly6G细胞的频率降低(扩展数据图3c)。将抗Ly6G抗体与抗CTLA-4和抗PD-1抗体联合使用显著加速了肿瘤生长,并削弱了双重免疫检查点抑制剂在两个模型中的反应(图4a、b)。此外,流式细胞术分析显示,双重免疫检查点抑制剂治疗后,肿瘤内免疫细胞频率的增加被抗Ly6G抗体所抵消,并且缺乏中性粒细胞的肿瘤微环境中,肿瘤内细胞毒性CD8 T细胞(CD8 granzyme B细胞分数)的频率显著降低(图4c)。
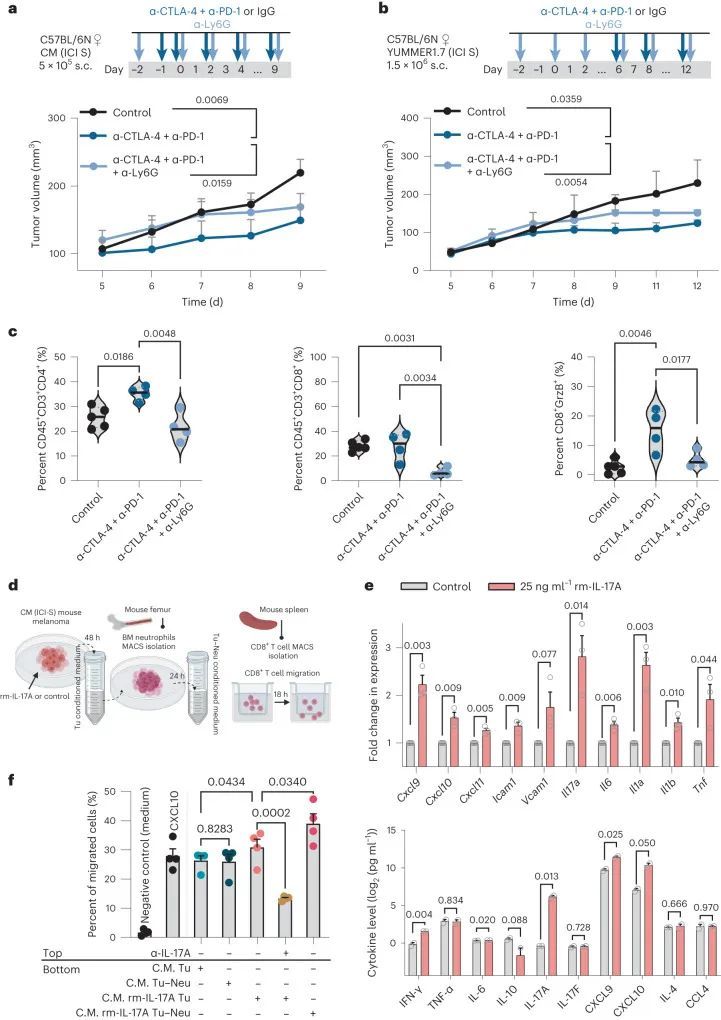
IL-17A和T17细胞因子预测对双重ICI的反应
作者的研究结果迄今表明,IL-17有助于增强双重ICI治疗的反应,并可作为治疗分层生物标志物。因此,作者分析了121例在埃森皮肤科部门接受治疗的黑色素瘤患者的血浆样本,其中70例接受第一线双重ICI治疗(抗CTLA-4加抗PD-1抗体),51例接受第一线抗PD-1单药治疗(图5a,f)。在治疗基线和早期随访(中位数为第9周,范围为2-12周)收集的样本中,双重ICI治疗的治疗反应者的分泌IL-17A水平显著高于非反应者(基线P = 0.0338,随访P = 0.0018;图5b)。为了测试基线IL-17A水平是否可以作为治疗前分层的生物标志物,作者根据患者的基线IL-17A血浆浓度对其进行分类。作者应用生物信息学工具X-tile来实现基于最佳切点的预测。作者发现,基线IL-17A浓度较高(≥3.76 pg/ml)的双重ICI治疗患者的无进展生存期(PFS)较长,而中等浓度(2.30-3.75 pg/ml)的患者则较短(P = 0.0682;HR,0)。46) 或低(≤2.29 pg ml ?1 ; P = 0.0199; HR, 0.32)基线IL-17A水平(图(图5c))。为了测试升高的IL-17A是否表明全局T H 17细胞因子谱和表型诱导,作者应用了一种基于珠子的多重细胞因子阵列,其中包括几种已知的T H 17、1型和2型辅助T细胞、炎症和CD8 + T细胞-自然杀伤细胞(NK)(CD8/NK)激活相关的细胞因子。有趣的是,双ICI疗法反应者在基线时具有更高的T H 17相关细胞因子(IL-10、IFN-γ、IL-17A和IL-22;P < 0.05)水平,尤其是在基线时(图5d,e)。虽然其他炎症和CD8/NK细胞因子在反应者的基线和随访样本中也升高,但它们在统计学上没有对患者进行分层(图5d,e)。
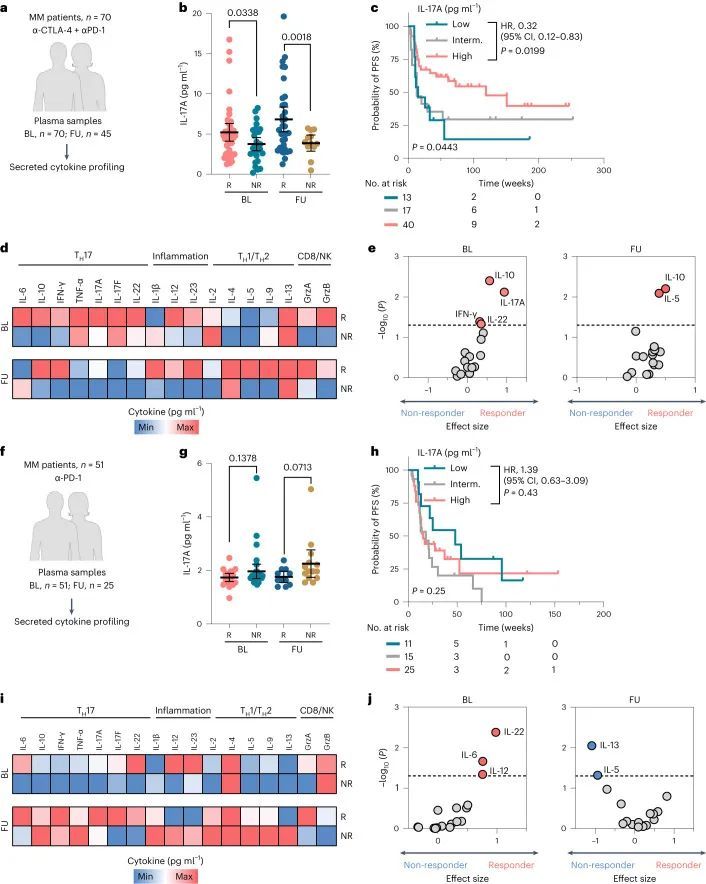
相比之下,抗PD-1单药治疗的反应与血浆IL-17A水平没有统计学上显著的相关性,尽管在非反应者中IL-17水平升高的趋势不显著(图5f-h)。对单一抗PD-1队列中的额外细胞因子进行分析显示,治疗反应者与非反应者之间的差异较小,只有基线IL-6、IL-22和IL-12(P < 0.05)能够显著地根据患者的反应进行分层。有趣的是,与双重ICI反应者相反,单一抗PD-1反应者的T17细胞因子在随访时较基线血浆样本中更高(统计学上不显著,P = 0.5781;图5i,j)。
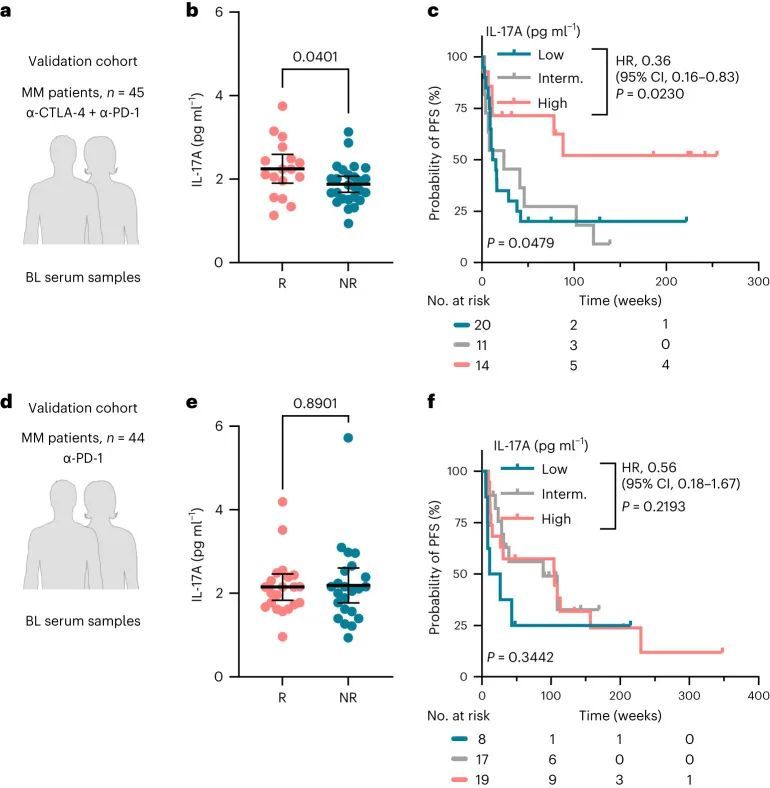
最后,作者使用了一个多中心验证队列来验证这些发现。作者独立收集了来自德国的图宾根、曼海姆和埃森以及瑞士的圣加仑四个不同皮肤科部门的45名接受双重ICI治疗(抗CTLA-4和抗PD-1抗体)的黑色素瘤患者和44名接受单一抗PD-1治疗的黑色素瘤患者的基线血清样本(图6a,d)。作者确认高基线IL-17A水平与双重ICI治疗的反应(P = 0.0401,反应者与非反应者;图6b)和更长的无进展生存期(P = 0.0230;HR,0.36;图6c)相关。相比之下,基线IL-17A水平与单一抗PD-1治疗的反应无关(P > 0.05;图6e,f)。
总结
总之,作者的数据表明,IL-17A可能作为预测双重ICI治疗反应的生物标志物。IL-17A细胞因子水平可以通过常见的分析生物化学测定(例如,酶联免疫吸附试验(ELISA))进行测量,这些测定方法在临床常规中易于获取和应用于各个机构。为了充分发挥基于细胞因子的治疗选择的益处,需要在更大的前瞻性队列中研究一些分子参数,例如正常基线阈值或治疗下的细胞因子浓度动态,并整合系统性的纵向采样方案。对这篇文章的思路感兴趣的老师,欢迎咨询!
本文来自互联网用户投稿,该文观点仅代表作者本人,不代表本站立场。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。 如若内容造成侵权/违法违规/事实不符,请联系我的编程经验分享网邮箱:chenni525@qq.com进行投诉反馈,一经查实,立即删除!
- Python教程
- 深入理解 MySQL 中的 HAVING 关键字和聚合函数
- Qt之QChar编码(1)
- MyBatis入门基础篇
- 用Python脚本实现FFmpeg批量转换
- OFDM系统信道估计误码率matlab仿真,对比LS,LMMSE,LR-LMMSE三种信道估计算法
- 2024年需要高度关注的六大网络安全威胁
- JavaScript DOM表单相关操作之相关案例
- 微信小程序登录(生成token,token校验)——后端
- 利用浏览器开发者工具进行网页性能优化
- 什么是动态IP?静态IP和动态IP有什么区别?
- 【操作系统】存储器管理
- 虚幻UE 材质-材质基础
- Java中文乱码浅析及解决方案
- 项目解决方案:商务大楼(大厦)网络高清视频监控建设方案